Une voie pour les métastases cérébrales du cancer du sein
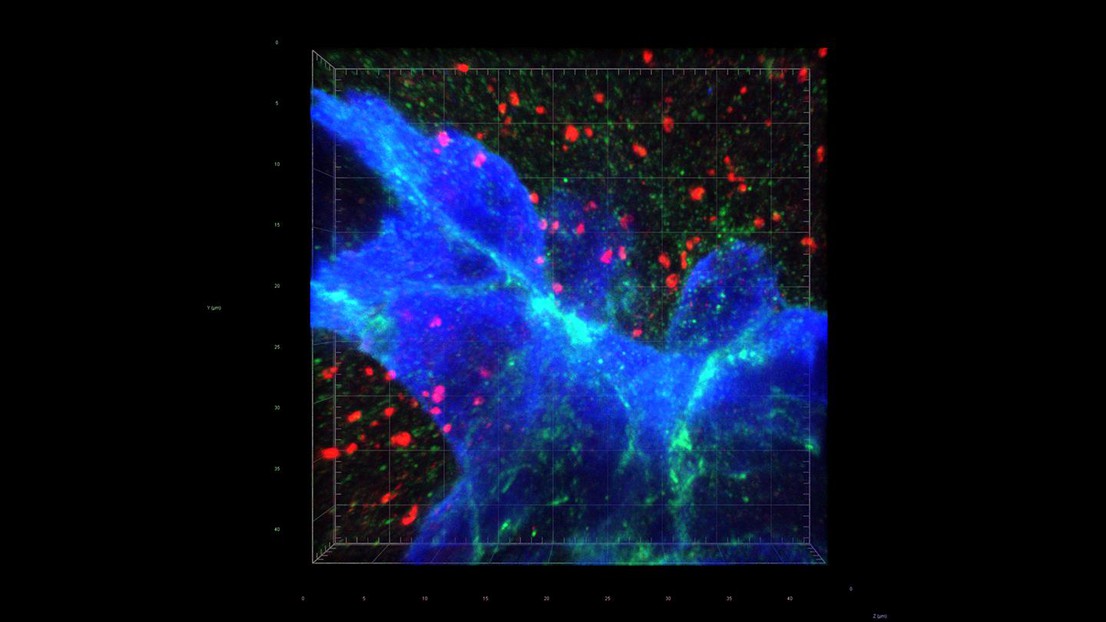
La proximité synaptique ouvre la voie aux métastases cérébrales. Crédit: W. Jiao et Q. Zeng (EPFL)
Des scientifiques de l’Institut suisse de recherche expérimentale sur le cancer de l’EPFL ont découvert une voie de signalisation que les tumeurs mammaires utilisent pour former des métastases dans le cerveau. Leur travail a été publié dans la revue Nature.
En 2018, le cancer du sein était le cancer le plus répandu chez les femmes à l’échelle mondiale, représentant environ un quart de tous les cancers déclarés. Les métastases sont l’un des principaux problèmes de tous types de cancers. Celles du cancer du sein ciblent fréquemment le cerveau.
La fréquence des métastases cérébrales du cancer du sein a amené les scientifiques à suspecter qu’il existait une raison sous-jacente expliquant pourquoi les cellules cancéreuses mammaires cherchaient à provoquer une croissance de la tumeur dans le cerveau. Découvrir cette raison pourrait permettre de limiter les métastases cérébrales du cancer du sein, voire de les éviter.
Des scientifiques de l’Institut suisse de recherche expérimentale sur le cancer (ISREC) de l’EPFL ont découvert que ce processus impliquait le récepteur N-méthyl-D-aspartate (récepteur NMDA ou NMDAR), que l’on trouve sur les membranes cellulaires de neurones et qui joue un rôle dans la transmission d’impulsions nerveuses. Leurs résultats ont été publiés dans la revue Nature. Le NMDAR est activé par le glutamate, un acide aminé libéré par les neurones présynaptiques durant la transmission synaptique de ces impulsions.
Par le passé, le groupe de l’ISREC a montré que la signalisation du NMDAR stimulé par le glutamate favorise la croissance invasive des tumeurs neuroendocrines et pancréatiques ductulaires, et que ce circuit de signalisation neuronal assimilé s’accompagne généralement d’un mauvais pronostic de traitement pour un certain nombre de types de cancers. Lorsque les scientifiques ont commencé à chercher les candidats à l’origine des métastases cérébrales du cancer du sein, le NMDAR se trouvait en tête de liste.
Leur recherche a porté ses fruits. Les scientifiques ont cultivé en laboratoire des cellules métastatiques cérébrales du cancer du sein afin d’étudier leur relation avec le NMDAR. Comme on pouvait s’y attendre, ils ont découvert que ces cellules intégraient l’ensemble du système par lequel le NMDAR transmet ses effets aux neurones, ce que les biologistes appellent une «voie de signalisation».
Il semble donc que l’activation du NMDAR soit l’origine clé des métastases vers le cerveau. Bien que certaines cellules cancéreuses sécrètent suffisamment de glutamate pour activer elles-mêmes le NMDAR, l’étude en question a mis en évidence que les cellules du cancer du sein n’en sont pas capables à elles seules. Comment parviennent-elles donc à activer le récepteur NMDA?
Les chercheurs ont fait une découverte capitale: les cellules du cancer du sein forment de «fausses» synapses avec les neurones qui sécrètent normalement du glutamate, qui sert de neurotransmetteur. La synapse est dite «pseudo-tripartite» car elle ressemble à une synapse tripartite entre deux neurones et les cellules gliales de soutien non neuronales (p. ex. les astrocytes).
Une fois que les synapses sont formées, les neurones fournissent du glutamate en quantité aux cellules du cancer du sein, et le récepteur NMDA s’active, permettant ce que les auteurs appellent une «logique insidieuse pour les métastases cérébrales».
«La découverte de ce mécanisme remarquable pour alimenter la croissance des tumeurs métastatiques dans le cerveau vient enrichir une base de connaissances croissante sur les paramètres des métastases. Nous espérons qu’elle sera applicable à la prévention et à la thérapie, déclare Douglas Hanahan, le directeur de l'ISREC qui a dirigé la recherche. L’enjeu réside dans la proximité insidieuse des cellules cancéreuses par rapport aux synapses neuronales normales, pour lesquelles la signalisation du NMDAR est essentielle. Ainsi, lors d’une prochaine recherche, nous devrons chercher avec d’autres scientifiques des vulnérabilités spécifiques des cellules métastatiques du cancer du sein alimentées par du glutamate afin de les cibler thérapeutiquement pour bloquer les métastases cérébrales, tout en épargnant les neurones adjacents normaux.»
--
Le laboratoire du professeur Douglas Hanahan fait partie de l’Institut Suisse de Recherche Expérimentale sur le Cancer (ISREC) à la Faculté des sciences de la vie de l’EPFL. L’ISREC de l’EPFL appartient au Centre suisse du cancer – Arc lémanique (SCCL), un groupe pluridisciplinaire de recherche fondamentale, translationnelle et clinique sur le cancer. Les membres fondateurs du SCCL sont le Centre hospitalier universitaire vaudois (CHUV), les Hôpitaux universitaires de Genève (HUG), les universités de Lausanne (UNIL) et de Genève (UNIGE) ainsi que l’EPFL.
Autres contributeurs
- Children’s National Medical Center, Washington DC
- EPFL BioEM Facility
- Institut des neurosciences, EPFL
- Université de Berne
- Université de Cambridge
- Université de Lausanne (UNIL)
- Institut Suisse de Bioinformatique
Fonds national suisse de la recherche scientifique, Conseil européen de la recherche, Fondation Biltema (via la Fondation ISREC)
Qiqun Zeng, Iacovos P. Michael, Peng Zhang, Sadegh Saghafinia, Graham Knott, Wei Jiao, Brian D. McCabe, José A. Galván, Hugh P. C. Robinson, Inti Zlobec, Giovanni Ciriello, Douglas Hanahan. Synaptic proximity enables NMDAR signaling to promote brain metastasis. Nature 18 septembre 2019. DOI: 10.1038/s41586-019-1576-6