Venir à bout du casse-tête de la maladie de Parkinson
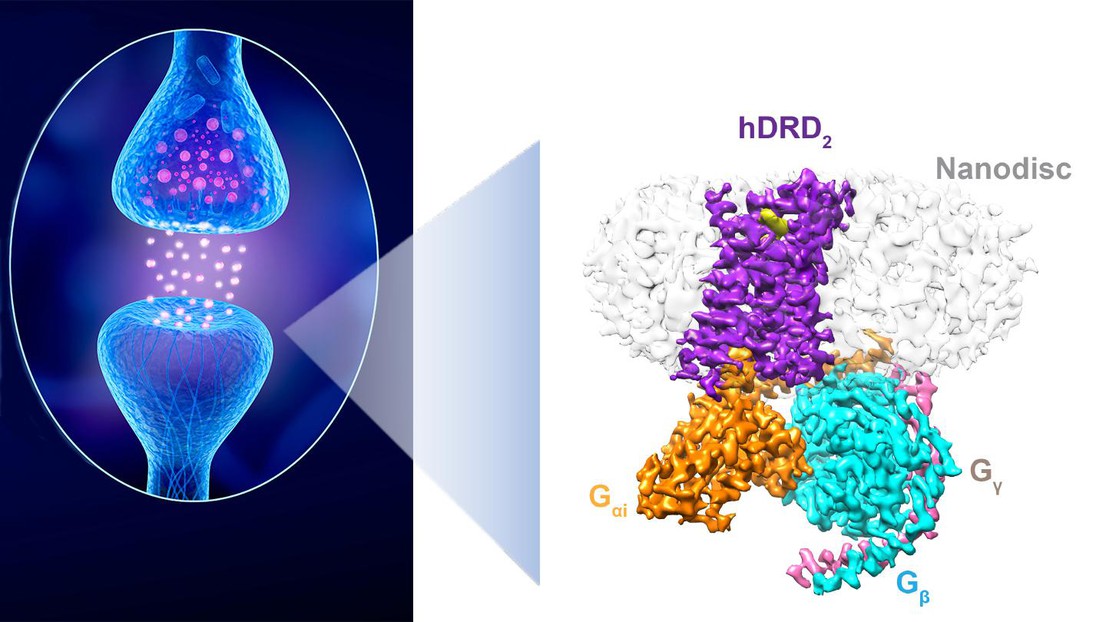
Synapse dopaminergique entre un neurone libérant de la dopamine et un neurone sensible à ce neurotransmetteur. À droite: Structure d’un récepteur D2 « en action ». Crédit: iStock et P. Barth (EPFL)
Les chercheurs de l’EPFL, en collaboration avec les scientifiques de l’UTSW et de l’UCSD, ont mis au point une approche informatisée de la conception de protéines et l’ont utilisée pour obtenir la toute première structure haute résolution d’un récepteur dopaminergique activé.. Cette avancée majeure laisse entrevoir une nouvelle voie vers la découverte d’un médicament contre la maladie de Parkinson, et éventuellement d’autres pathologies.
La dopamine est un neurotransmetteur qui intervient dans tous les domaines, des fonctions cognitives supérieures au contrôle moteur, à la motivation, l’excitation, le renforcement et le plaisir sexuel. Les récepteurs sur lesquels elle agit sont depuis longtemps la cible des traitements de diverses pathologies, comme la maladie de Parkinson, provoquée par la dégénérescence de neurones de contrôle du mouvement qui utilisent la dopamine.
Problème: depuis au moins deux décennies, personne n’a jamais pu « voir » à quoi ressemble un récepteur dopaminergique activé par la dopamine, en tout cas pas avec une résolution suffisante pour ouvrir la voie à la conception de médicaments capables de cibler efficacement ces récepteurs.
Dans une étude collaborative majeure publiée dans Nature, les chercheurs du laboratoire de Patrick Barth de l’EPFL, se sont associés à des confrères de l’UTSW, l’École médicale du Sud-Ouest du Texas, et de l’UCSD, l’Université de Californie à San Diego, et ont pu calculer la structure haute résolution d’une forme activée d’un récepteur dopaminergique dans l’environnement d’une membrane lipidique native. «Le récepteur natif a un comportement si imprévisible et sa forme active est si brève que toutes les tentatives d’observation de la structure du récepteur ‘en action’ ont échoué jusqu’à présent», regrette Patrick Barth.
Les chercheurs ont résolu le problème en combinant des approches computationnelles dernier cri de conception de protéines de novo et de protéines allostériques, développées par le groupe de Barth, ce qui leur a permis de fabriquer un récepteur dopaminergique très stable mais activé, dont ils ont pu étudier et définir la structure.
L’équipe de l’EPFL a créé un récepteur avec des constituants artificiels, à base de commutateurs d’activation et de sites de liaison de novo, qui ont remplacé les régions instables, structurellement désordonnées et d’inactivation du récepteur natif.
«Cette approche hybride computationnelle de conception de protéines à la fois fonctionnelle et de novo est puissante car elle nous a permis de créer un récepteur doté d’une activité et d’une stabilité considérablement accrues, tout en reprenant les fonctionnalités natives essentielles comme la liaison et la signalisation intracellulaire dopaminergique», explique Patrick Barth.
Les techniques de reconstitution lipidique haut de gamme et la cryomicroscopie électronique ont aussi participé au succès du projet, car elles ont permis de surmonter les obstacles des études précédentes qui ont tenté de déterminer la structure du récepteur à l’aide de la cristallographie aux rayons X et en maintenant le récepteur dans des détergents.
Le problème est que les détergents sont de très mauvais imitateurs des membranes cellulaires lipidiques où sont naturellement placés les récepteurs comme ceux de la dopamine. Ils ont aussi la réputation de déformer et même inactiver les récepteurs, ce qui est plutôt gênant quand on cherche justement à savoir à quoi ils ressemblent quand ils sont activés. «Il s’agit de la première structure de récepteur membranaire au niveau atomique déterminée dans une bicouche lipidique native», se réjouit Patrick Barth.
«Cette avancée majeure va permettre d’améliorer les efforts visant à découvrir de nouveaux médicaments, par exemple pour lutter contre la maladie de Parkinson», ajoute-t-il. «Mais elle plante aussi le décor pour approfondir le champ d’application des approches de conception de protéines de novo et fonctionnelles, en vue d’accélérer la détermination structurelle de cibles protéiques complexes et de créer des protéines aux fonctions nouvelles pour toutes sortes d’applications thérapeutiques et biotechnologiques».
Edward Mallinckrodt, Jr. Foundation
Welch Foundation
EPFL
Ludwig Institute for Cancer research
UTSW
CPRIT
National Institutes of Health
Jie Yin, Kuang-Yui M. Chen, Mary J. Clark, Mahdi Hijazi, Punita Kumari, Xiao-chen Bai, Roger K. Sunahara, Patrick Barth, Daniel M. Rosenbaum. Structure of a D2 dopamine receptor-G protein complex in a lipid membrane. Nature 11 June 2020. DOI: 10.1038/s41586-020-2379-5