Une nouvelle méthode pour imprimer des organes miniatures
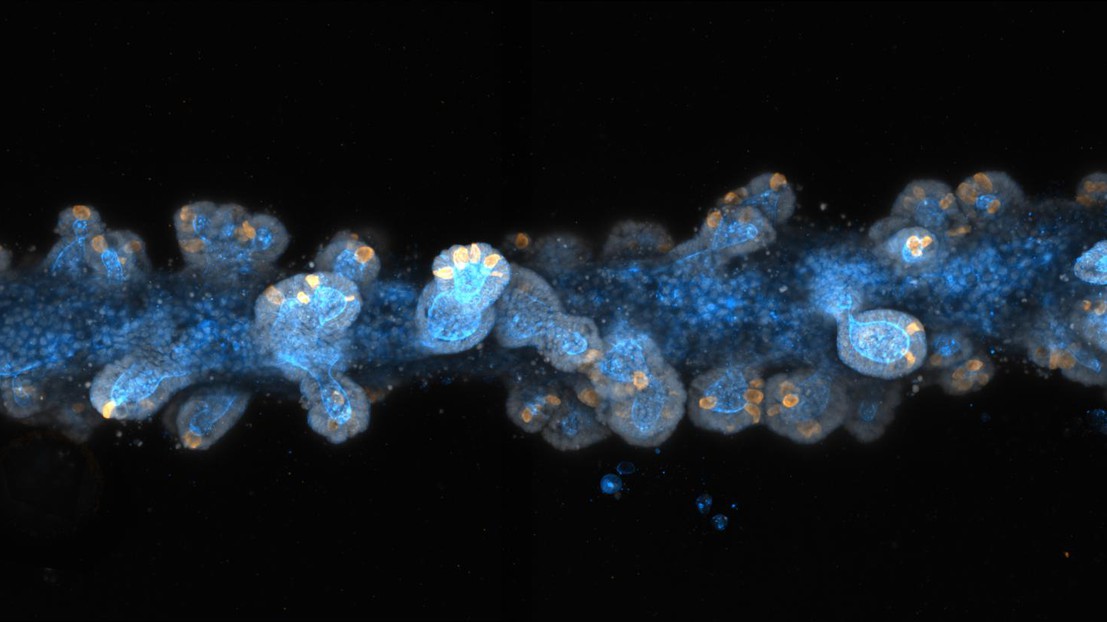
© 2020 EPFL
Les chercheurs de l’EPFL ont développé une approche pour imprimer des tissus miniatures dont l’apparence et le fonctionnement sont pratiquement similaires à ceux de leurs homologues de taille réelle. Mesurant seulement quelques centimètres, ces tissus miniatures offrent la possibilité d’étudier différents processus biologiques, voire de tester de nouvelles approches thérapeutiques.
Depuis quelques années, des versions miniatures d’organes tels que le cerveau, les reins et les poumons - connus sous le nom d’organoïdes - sont développées à partir de cellules souches. Les organoïdes présentent une alternative pour réduire les tests sur les animaux et améliorer les modèles permettant d’étudier comment se forment les organes humains et comment certains processus dégénèrent en cas de maladie. Avec les approches conventionnelles pour obtenir des organoïdes, les cellules souches fusionnent et se développent en formant des sphères de quelques micromètres à quelques millimètres de diamètre. «Ce n’est pas physiologique, car de nombreux organes comme l’intestin ou les voies respiratoires sont en forme de tube et sont beaucoup plus grands», affirme Matthias Lütolf, professeur à l’Institut de Bio-ingénierie de l’EPFL, qui a dirigé l’étude publiée dans Nature Materials.
Pour développer de plus grands organoïdes similaires aux tissus qu’ils modélisent, Matthias Lütolf et son équipe se sont tournés vers la bio-impression. Une technologie similaire aux imprimantes 3D utilisées pour créer des objets du quotidien peut permettre aux bio-ingénieurs d’assembler des tissus vivants. À la place des plastiques ou poudres utilisés dans les imprimantes 3D traditionnelles, les bio-imprimeurs utilisent cependant des bio-encres, c’est-à-dire des liquides ou gels qui encapsulent des cellules vivantes. «La bio-impression est très intéressante, car elle permet de déposer des cellules n’importe où dans un espace 3D. Vous pouvez ainsi agencer des cellules dans une configuration de type organe comme un tube», déclare Matthias Lütolf.
Les chercheurs ont créé une installation de bio-impression sur mesure composée d’un microscope et d’un appareil qui peut aspirer et déposer des cellules par le biais d’un mince embout associé à une pompe à seringue. Sur la platine du microscope se trouve une plaque de culture sur laquelle est déposé un gel similaire à l’environnement extracellulaire complexe présent dans de nombreux tissus. Selon Matthias Lütolf, ce type de gel «est très puissant et permet aux cellules de former un tissu. Mais il n’avait pas encore réellement été exploité pour la bio-impression.»
En déplaçant la platine du microscope et en surveillant constamment le processus par les oculaires, les chercheurs ont pu déposer dans le gel une lignée de cellules souches intestinales de quelques centimètres de long. «Ce qui est pratique avec un microscope, c’est que vous pouvez toujours voir ce que vous faites et aussi observer comment les cellules se comportent en temps réel», explique Matthias Lütolf. «Dans d’autres approches de bio-impression, vous ne voyez pas ce qui se passe.»
Une fois les cellules souches déposées, «la magie opère», ajoute Matthias Lütolf. Les cellules commencent à se développer et à interagir entre elles, formant un tissu continu en forme de tube dont la plupart des caractéristiques anatomiques et fonctionnelles sont comparables à celles d’un intestin in vivo. Ainsi les intestins développés en laboratoire, mesurant jusqu’à trois centimètres de long, présentent des structures rappelant les cryptes et contenant les cellules souches, ainsi que les mêmes cellules absorbantes et sécrétoires spécialisées que celles trouvées dans un intestin de taille réelle. Les cellules sécrétoires des intestins miniatures peuvent également libérer des molécules antimicrobiennes en réponse à des stimuli spécifiques, une caractéristique fonctionnelle importante.

La spécificité de l’approche récemment développée et sa réussite par rapport aux méthodes préexistantes s’expliquent par le fait qu’elle combine la flexibilité et la précision de l’impression 3D avec la capacité des cellules souches des organoïdes à se développer et s’organiser. «Nous laissons la biologie opérer, c’est absolument essentiel», souligne Matthias Lütolf.
En bio-imprimant des cellules souches dérivées d’organoïdes du tractus gastro-intestinal, les chercheurs ont également généré des portions de l’estomac, de l’intestin grêle et du côlon, pour former ensuite des versions miniatures interconnectées de leurs organes parents. Avec les méthodes traditionnelles, «vous pouvez faire croître des organoïdes d’estomac ou d’intestin, alors qu’avec la bio-impression, vous pouvez combiner différents types de cellules et les agencer de différentes manières», affirme Matthias Lütolf.
Même si les tissus miniatures ressemblent à leurs organes parents, leur utilisation en médecine régénérative, y compris pour le remplacement de tissus et organes humains, n’est pas pour demain selon Matthias Lütolf. Mais il fait observer que l’approche récemment développée pourrait être utilisée pour constituer des modèles pour les maladies humaines, dont le cancer, et pour étudier comment des médicaments en phase de test agissent sur certains types de cellules spécifiques d’un tissu.
L’équipe de Matthias Lütolf espère maintenant utiliser la bio-impression pour créer des tubes de voies respiratoires afin d’étudier les infections virales, par exemple avec le virus du SARS-CoV-2 à l’origine du Covid-19. Les voies respiratoires miniatures infectées pourraient alors permettre de tester différentes approches de traitement. «L’avantage avec un microscope, c’est que vous pouvez observer l’évolution de l’infection. Vous pouvez donc quantifier et étudier ce qui se passe», déclare Matthias Lütolf. «C’est une perspective très prometteuse.»
Jonathan A. Brassard, Mike Nikolaev, Tania Hübscher, Moritz Hofer & Matthias P. Lutolf. Recapitulating macro-scale tissue self-organization through organoid bioprinting. Nat. Mater. (2020).