Une nouvelle étude pour comprendre la biologie de la leucémie
Cellules blastiques dans la leucémie (iStock Photos)
Des scientifiques de l'EPFL ont conduit une étude intensive sur la cause de la leucémie qui pourrait sensiblement améliorer la manière dont nous traitons cette maladie.
La leucémie affecte 350'000 personnes dans le monde. Il s'agit d'un cancer des globules blancs, qui sont les cellules du système immunitaire et sont générées par des cellules-souches dans la moelle osseuse. Il existe deux types de leucémie chronique, et deux types de leucémie aiguë. L'une des formes chroniques, la leucémie myéloïde chronique, représente environ 20% de tous les cas; elle est provoquée par une enzyme mutée dont l'activité est hors de contrôle. Cette enzyme apparaît en deux tailles, la seconde étant associée avec la leucémie lymphocytaire aiguë. Du fait qu'elle est la cible des traitements courants de la leucémie, il est essentiel de comprendre le rôle que joue cette enzyme. Des scientifiques de l'EPFL viennent de recourir à la protéomique pour comparer de manière intensive les deux formes de l'enzyme, et apporter une vision beaucoup plus claire de la manière dont elle peut causer différentes formes de leucémie. Ces travaux, publiés dans Leukemia, ouvrent des perspectives pour des améliorations en matière de médicaments et de thérapie.
La leucémie myéloïde chronique apparaît lorsque deux chromosomes, à l'intérieur des cellules-souches de la moelle osseuse, échangent des composants spécifiques. Le chromosome qui en résulte est appelée «Philadelphia», et contient désormais un gène fusionné qui produit une enzyme anormale nommée Bcr-Abl.
Cette enzyme, qui est active en permanence, existe en deux tailles différentes, ou isoformes: la plus grande (p210) est associée à la leucémie myéloïde chronique, tandis que la plus courte (p190) est liée à la leucémie lymphocytaire aiguë, une forme à développement rapide qu'il est très difficile de traiter et qui conduit à la mort du patient en quelques mois. Les données existantes relatives aux différences des deux isoformes Bcr-Abl sont contradictoires et sources de confusion, ce qui signifie que nous avons besoin de davantage de précision quant à son rôle dans le développement de ce type de cancer.
Le laboratoire d'Oliver Hantschel à l'EPFL, en étroite collaboration avec la Plateforme technologique de protéomique de la Faculté des Sciences de la Vie, a eu recours à une approche protéomique pour étudier les deux isoformes de Bcr-Abl. La protéomique est un domaine de pointe qui utilise l'analyse par spectrométrie de masse et qui permet de déterminer l'ensemble des protéines d'un organisme, appelé le protéome.
Les chercheurs se sont intéressés à deux facteurs: d'une part, toutes les manières dont chaque isoforme Bcr-Abl interagit avec d'autres molécules dans la cellule, ou son «interactome». Cela leur a permis de déterminer la manière dont les deux isoformes travaillent avec d'autres molécules. D'autre part, l'équipe s'est intéressée à la phosphoprotéomique des isoformes. Cela se réfère à une modification – la phosphorylation – que de nombreuses protéines, y compris Bcr-Abl, subissent dans la cellule, par laquelle elles sont activées avec l'addition d'un groupe phosphate. Au moyen de la spectroscopie de masse, les chercheurs ont pu identifier et comparer des centaines de protéines phosphorylées dans les cellules leucémiques.
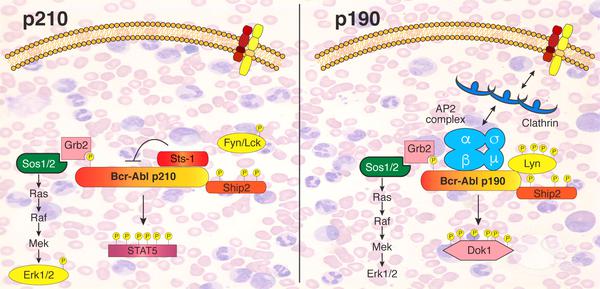
Ce schéma décrit les réseaux de signalisation des deux isoformes Bcr-Abl déterminés dans cette étude. (Crédit: Sina Maren Reckel/EPFL)
En comparant les deux, les chercheurs ont pu déterminer qu'il existe des différences «étonnamment grandes» entre l'interactome et le phosphoprotéome des deux isoformes, bien qu'ils soient tous les deux «activés» largement de la même manière. Ces différences dans les interactions et l'activation pourraient être liées à la manière dont chaque isoforme induit une forme complètement différente de leucémie, et ouvrent des pistes pour cibler Bcr-Abl par des moyens plus économiques et plus efficaces pour traiter la maladie.
Cette étude résulte de la collaboration de l'Institut de recherches expérimentales sur le cancer (ISREC) de l'EPFL, et de sa Plateforme technologique de protéomique. Elle a été financée par la Fondation ISREC, le Fonds national suisse et le Pôle de recherche national Biologie chimique (PNR-NCCR).
Référence
Sina Reckel, Romain Hamelin, Sandrine Georgeon, Florence Armand, Qinfang Jolliet, Diego Chiappe, Marc Moniatte, Oliver Hantschel. Differential signaling networks of Bcr-Abl p210 and p190 kinases in leukemia cells defined by functional proteomics.Leukemia 23 January 2017. DOI: 10.1038/leu.2017.36