Une fenêtre dans le système nerveux de la mouche à vinaigre

Une mouche à vinaigre Drosophila melanogaster implantée (au premier plan) interagissant avec une mouche intacte (à l'arrière-plan). Crédit : 2022 EPFL/Alain Herzog - CC-BY-SA 4.0
Des scientifiques de l’EPFL ont mis au point une technique d’implantation qui permet un accès optique sans précédent à la «moelle épinière» de la mouche à vinaigre Drosophila melanogaster. Ces travaux pourraient aboutir à des avancées dans les domaines des neurosciences, de l’intelligence artificielle et de la robotique bio-inspirée.
«Pour comprendre le contrôle moteur biologique, il faut pouvoir enregistrer l’activité neuronale des animaux en mouvement», explique le professeur Pavan Ramdya de la Faculté des sciences de la vie de l’EPFL. «On dénombre un milliard de neurones dans la moelle épinière humaine, ce qui est gigantesque, et on ne peut pas manipuler les neurones des êtres humains de la même manière que pour les animaux. La mouche à vinaigre ou drosophile est un organisme très petit que l’on peut manipuler génétiquement et dont l’activité de la quasi-totalité des circuits moteurs peut être observée par imagerie.»
Depuis des années, les travaux de recherche de Pavan Ramdya sont axés sur la récapitulation numérique des principes sous-jacents au contrôle moteur de la drosophile. En 2019, son équipe a publié DeepFly3D, un logiciel d’apprentissage profond basé sur la capture de mouvements, qui utilise de nombreuses vues de caméra pour quantifier en 3D les mouvements des membres des mouches. En 2021, l’équipe de Ramdya a présenté LiftPose3D, une méthode de reconstruction 3D de poses d’animaux à partir d’images 2D prises avec une seule caméra. Ces travaux ont été complétés par sa publication en 2022 de NeuroMechFly, un premier «jumeau» numérique morphologiquement semblable à la drosophile.
Mais il y a toujours d’autres défis à relever, notamment dans ce domaine qui se situe à la croisée de la biologie, des neurosciences, de l’informatique et de la robotique. L’objectif n’est pas seulement de cartographier et de comprendre le système nerveux d’un organisme – une tâche ambitieuse en soi – mais aussi de découvrir comment développer des robots bio-inspirés aussi agiles que les mouches.
«L’obstacle auquel nous étions confrontés avant ces travaux», précise Pavan Ramdya, «était que nous pouvions seulement enregistrer les circuits moteurs de la mouche pendant une courte période avant la détérioration de la santé de l’insecte».
C’est ainsi que Pavan Ramdya s’est associé au professeur Selman Sakar de la Faculté des sciences et techniques de l’ingénieur de l’EPFL pour développer des outils destinés à surveiller l’activité neuronale de la drosophile pendant de plus longues périodes, jusqu’à la vie entière de l’insecte. Ce projet a été piloté par Laura Hermans, doctorante qui a été co-supervisée par Pavan Ramdya et Selman Sakar.
Une fenêtre dans le cordon nerveux ventral
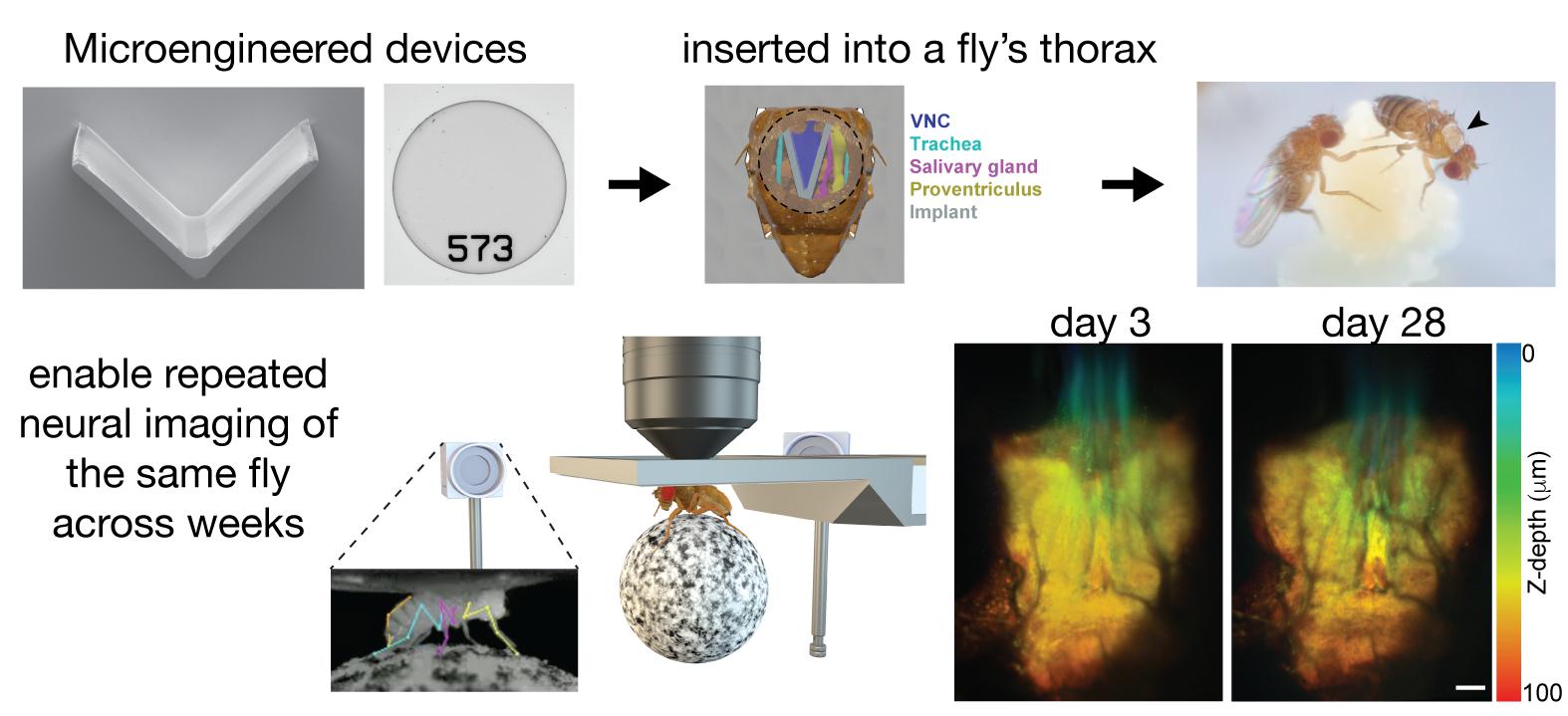
«Nous avons mis au point des dispositifs microtechniques qui permettent un accès optique au cordon nerveux ventral de l’animal», explique Laura Hermans, faisant référence à l’équivalent de la moelle épinière chez la mouche. «Ensuite, nous avons implanté ces dispositifs par chirurgie dans le thorax de la mouche», poursuit-elle. «L’un de ces dispositifs, un implant, nous permet de déplacer les organes de la mouche pour faire apparaître le cordon nerveux ventral qui se trouve en dessous. Ensuite, nous fermons le thorax avec une fenêtre microfabriquée transparente. Une fois que la mouche est équipée de ces dispositifs, nous pouvons enregistrer son comportement ainsi que son activité neuronale lors de nombreuses expériences sur de longues durées.»
Tous ces outils permettent aux scientifiques d’observer un animal sur de longues périodes. Ils peuvent désormais réaliser des expériences qui durent au-delà de quelques heures et même pendant toute la vie de la mouche. «Par exemple, nous pouvons étudier l’adaptation de la biologie d’un animal pendant la progression d’une maladie», ajoute Laura Hermans. «Nous pouvons également étudier les changements de l’activité des circuits neurologiques et leur structure pendant le vieillissement. Le cordon nerveux ventral de la mouche est parfait car il abrite les circuits moteurs de l’insecte, ce qui nous permet d’étudier l’évolution de la locomotion au fil du temps ou après une blessure.»
L’implant
«En tant qu’ingénieurs, nous nous passionnons pour de tels défis techniques bien définis», confie Selman Sakar. «L’équipe de Pavan a mis au point une technique de dissection permettant de retirer les organes de la mouche qui bloquent le champ de vision et de visualiser le cordon nerveux ventral. Mais les mouches ne peuvent survivre que quelques heures après la chirurgie. Nous étions convaincus qu’un implant devait être placé à l’intérieur du thorax. Il existe des techniques analogues pour visualiser le système nerveux d’animaux de plus grande taille comme les rats. Nous nous sommes inspirés de ces solutions et avons commencé à réfléchir au problème de miniaturisation.»
Avec les premiers prototypes, le défi était de parvenir à déplacer et à conserver les organes de la mouche pour faire apparaître le cordon nerveux ventral, tout en permettant à la mouche de survivre après la chirurgie.
«Pour relever ce défi, il vous faut des gens capables d’appréhender un problème tant du point de vue des sciences de la vie que du point de vue de l’ingénierie – cela souligne l’importance des travaux de Laura [Hermans] et de Murat [Kaynak]», explique Selman Sakar.
Les premiers implants étaient rigides, et très peu de mouches survivaient après la chirurgie. Améliorer les taux de survie sans sacrifier la qualité d’imagerie représentait un défi qui a nécessité plusieurs tentatives de conception. Au final, le produit retenu a été un prototype simple mais efficace: un implant en V souple qui peut déplacer sans danger les organes de la mouche, faire apparaître le cordon nerveux ventral, et permettre aux chercheuses et chercheurs de fermer le trou du cuticule avec une “fenêtre thoracique à code-barres”, ce qui leur permet d’observer le cordon nerveux ventral et de mesurer l’activité neuronale de la mouche dans son quotidien.
«Du fait des différences anatomiques entre les animaux, nous avons dû trouver une solution sure et adaptative», affirme Selman Sakar. «Notre implant répond à ce besoin spécifique. Avec le développement d’outils adaptés de micromanipulation des tissus et d’un plateau souple nano-imprimé en 3D pour maintenir les animaux lors de sessions d’imagerie répétées, nous fournissons une boîte à outils polyvalente complète pour la recherche en neurosciences.»
Une voie ouverte
Cette découverte est un exemple de la recherche ouverte et interdisciplinaire propre à l’EPFL. «Depuis toujours, nous sommes très ouverts au partage de la technologie», explique Selman Sakar. «L’idée ici est de faire connaître rapidement les outils et méthodes de sorte à faciliter le développement futur de la technologie et le processus de découverte qu’ils offrent dans de nombreux domaines de recherche. Je pense qu’un certain nombre d’équipes aimerait découvrir notre technologie.»
«En étudiant la mouche, on se dit que si on arrive à comprendre quelque chose de relativement simple, on peut être mieux préparés à comprendre des organismes plus compliqués», affirme Pavan Ramdya. «Lorsque vous apprenez les mathématiques, vous ne vous plongez pas dans l’algèbre linéaire, vous apprenez d’abord à additionner et à soustraire. Et pour la robotique, ce serait formidable de comprendre le fonctionnement d’un insecte même simple.»
La prochaine étape pour l’équipe consiste à utiliser sa nouvelle méthodologie pour découvrir les mécanismes de contrôle des mouvements de la drosophile. «Les systèmes biologiques sont vraiment incroyables par rapport aux systèmes artificiels dans la mesure où ils peuvent moduler dynamiquement, par exemple, l’excitabilité des neurones ou la force des synapses», ajoute Pavan Ramdya. «Ainsi, pour comprendre ce qui rend les systèmes biologiques si agiles, vous devez pouvoir observer ce dynamisme. Dans notre cas, nous aimerions voir comment, sur la durée de vie complète d’un animal, les systèmes moteurs réagissent au vieillissement ou à la récupération après une blessure.»
Fonds national suisse de la recherche scientifique (FNS)
Conseil européen de la recherche (Horizon 2020)
Fonds Boehringer Ingelheim
Conseil National pour la Science et la Technologie du Mexique (CONACYT)
EPFL
Laura Hermans, Murat Kaynak, Jonas Braun, Victor Lobato-Ríos, Chin-Lin Chen, Adam Friedberg, Semih Günel, Florian Aymanns, Mahmut Selman Sakar, Pavan Ramdya. Microengineered devices enable long-term imaging of the ventral nerve cord in behaving adult Drosophila. Nature Communications, 25 August 2022. DOI: 10.1038/s41467-022-32571-y