Une découverte prometteuse contre la maladie de Huntington
La maladie de Huntington provoque la destruction des neurones. @ iStockphoto
Des scientifiques du Brain Mind Institute de l’EPFL ont identifié une enzyme qui peut jouer un rôle décisif dans le développement d’une nouvelle piste pour le traitement de la maladie de Huntington.
La maladie de Huntington est une maladie du cerveau progressive et agressivement débilitante, qui entraîne des mouvements incontrôlés, des problèmes psychologiques et une perte de fonctions cognitives. Elle est causée par une mutation du gène qui code pour la protéine huntingtine, avec pour résultat la formation d’une extrémité anormalement longue d’acides aminés glutamine. L’allongement de cette extrémité empêche la huntingtine de se plier correctement et, en conséquence, elle s’agrège à l’intérieur des neurones, finissant par les tuer.
La maladie de Huntington affecte des centaines de milliers de personnes dans le monde et, comme il s’agit d’une maladie « autosomique dominante », il suffit que la personne possède une copie du gène muté de la huntingtine pour qu’elle développe la maladie. Dans les milieux académiques comme dans l’industrie, des scientifiques explorent diverses approches pour s'attaquer à la maladie. La stratégie la plus populaire consiste à abaisser les taux de huntingtine ou à inhiber son agrégation - ou à combiner ces deux approches. Pour ce faire, il faut soit « mettre sous silence » le gène de la huntingtine soit activer des mécanismes cellulaires qui favorisent la dégradation de la protéine elle-même.
Aujourd’hui, des scientifiques travaillant dans le laboratoire de Hilal Lashuel à l’EPFL ont identifié une nouvelle enzyme qui exerce ces deux effets. Cette enzyme, appelée « TBK1 », joue un rôle central dans le contrôle de la dégradation et de l’élimination de la protéine huntingtine et elle introduit dans celle-ci des modifications chimiques qui bloquent son agrégation. « Nous pensons que ceci représente une cible valable pour le développement d’un possible traitement de la maladie de Huntington, » déclare le professeur Lashuel.
L’enzyme TBK1 est une « kinase ». Dans la cellule, les kinases sont des enzymes qui ajoutent des groupes phosphates sur diverses biomolécules telles que des protéines ou l’ADN. Dans le monde de la cellule, les groupes phosphates sont des transporteurs d’énergie, de sorte que l’ajout d’un tel groupe « active » la molécule réceptrice.
De précédentes études ont montré que l’ajout artificiel de groupes phosphates sur la huntingtine peut l’empêcher de s'agréger et de provoquer la maladie de Huntington. « Cependant, pour explorer le potentiel thérapeutique de la phosphorylation, nous devions identifier la kinase naturelle qui fait ce travail à l’intérieur de la cellule », explique Hilal Lashuel. « Après avoir criblé des centaines de kinases, nous avons été enthousiasmés de pouvoir identifier TBK1, car cette kinase exerçait cet effet avec une haute spécificité et une grande efficacité. »
Les chercheurs ont trouvé que lorsque TBK1 ajoute un groupe phosphate à un endroit quelconque sur les 17 premiers acides aminés de la huntingtine, elle inhibe sa capacité à s'agréger. C’était le cas aussi bien pour la version normale que pour la version mutée de la huntingtine.
En outre, l’augmentation des taux cellulaires de TBK1 entraîne une hyperphosphorylation d’un acide aminé spécifique (la sérine) sur la chaîne de la huntingtine. Ceci stabilise la protéine et l’empêche de s'agréger.
Enfin, il est apparu que la TBK1 envoie également un signal à la cellule lui indiquant de dégrader et d’éliminer la huntingtine avant qu’elle ne s’agrège. Ceci abaisse globalement les taux de huntingtine, avec pour résultat une réduction de la formation d’agrégats à l’intérieur de la cellule.
Encouragés par leur découverte, les scientifiques sont ensuite passés à un modèle animal de la maladie de Huntington: le ver C. elegans. Ce qu’ils ont alors trouvé a corroboré leurs précédents résultats: la surexpression de la kinase TBK1 protégeait contre la toxicité de la huntingtine mutante chez le ver, empêchant ainsi le développement de la maladie de Huntington. Les chercheurs ont obtenu des résultats similaires dans des neurones en culture.
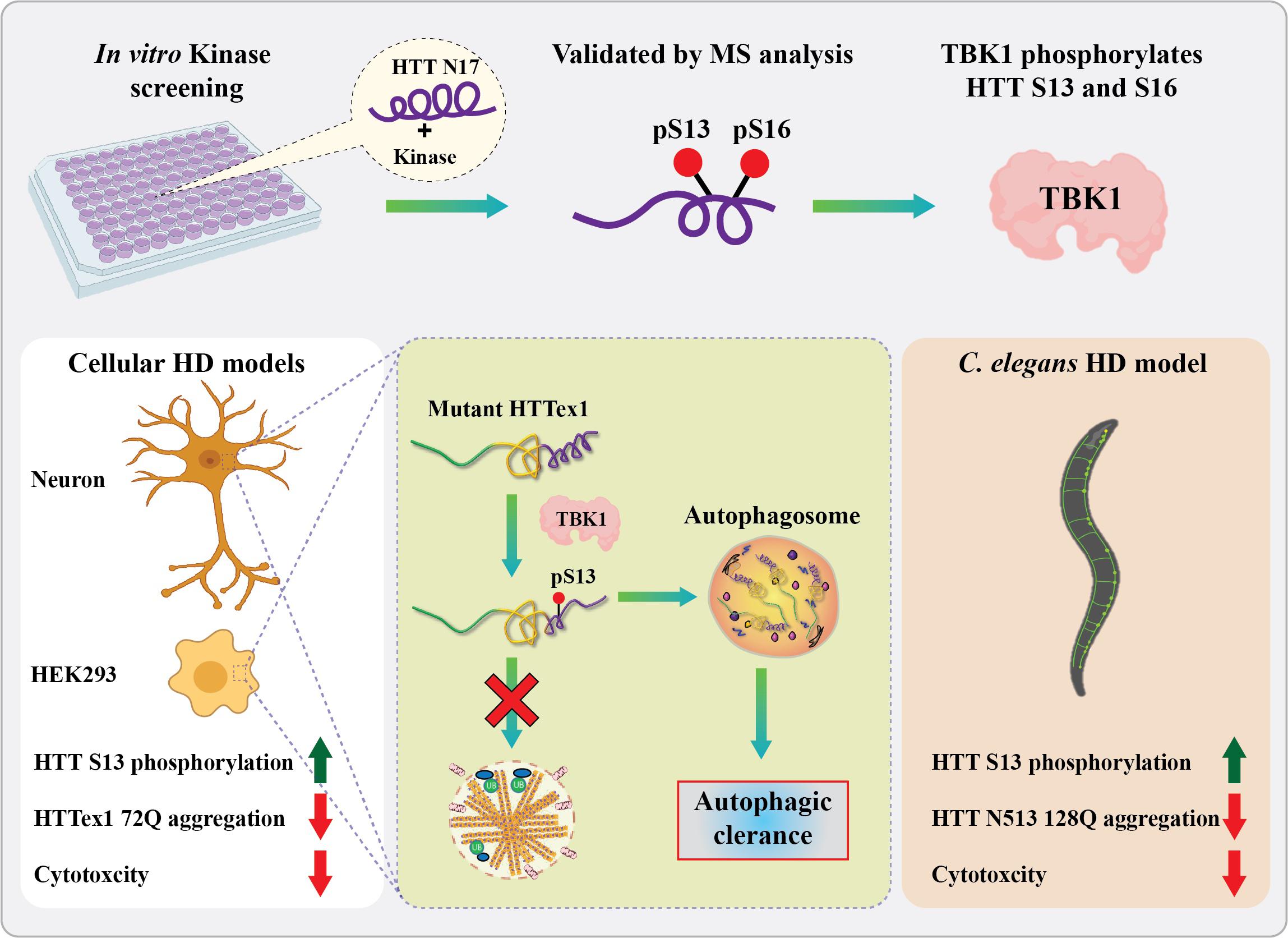
En appliquant un criblage in vitro du kinome, le laboratoire de Hilal Lashuel à l’EPFL a identifié une nouvelle kinase (TBK1) qui phosphoryle la protéine huntingtine sur S13 et S16 et ils ont montré que cette kinase joue un rôle vital dans le contrôle de l’agrégation, de l’élimination et de la toxicité de la huntingtine. Dans des cellules, TBK1 phosphoryle HTT sur S13, entraîne une réduction des agrégats de HTT mutante dans les cellules et dans C. elegans et protège contre la toxicité de HTT, par le biais d’un mécanisme qui implique une augmentation de la phosphorylation de HTT sur S13 et/ou favorise la clairance de la HTT soluble par autophagie. Crédit: R.N. Hegde et H. Lashuel (EPFL)
« Notre travail montre qu’une augmentation due à TBK1 de la phosphorylation et/ou le fait de promouvoir l’élimination par autophagie de la huntingtine mutante constituent des stratégies thérapeutiques valables pour le traitement de la maladie de Huntington », déclare Ramanath Hegde, qui a dirigé cette étude.
« Nous sommes enchantés de ces résultats », affirme Hilal Lashuel. « Il a été montré que TBK1 contrôle également la dégradation et l’élimination de protéines impliquées dans d’autres maladies neurodégénératives. Des mutations de TBK1 ont aussi été associées récemment à la sclérose latérale amyotrophique (SLA); ces mutations entraînent une inhibition de l’autophagie, ce qui aboutit à une accumulation d’agrégats. Notre objectif est de trouver de petites molécules ou des voies sur lesquelles agissent des médicaments et de les développer pour plusieurs maladies neurodégénératives. »
Autres contributeurs
IRBM Science Park, Italie
Johns Hopkins University School of Medicine
Laboratoire de physiologie intégrative et systémique de l’EPFL
University College London
University of Auckland
Fondation CHDI
National Institute of Neurological Disorders and Stroke
EPFL
Ramanath Narayana Hegde, Anass Chiki, Lara Petricca, Paola Martufi, Nicolas Arbez, Laurent Mouchiroud, Johan Auwerx, Christian Landles, Gillian P. Bates, Malvindar K. Singh-Bains, Mike Dragunow, Maurice A Curtis, Richard L. M. Faull, Christopher A. Ross, Andrea Caricasole, Hilal A Lashuel. TBK1 suppresses mutant HTT induced toxicity and pathology in models of Huntington's disease. EMBO xx xxxx 2020. DOI: 10.15252/embj.2020104671