Un médicament anti-cancer «boosté» par un antirhumatismal
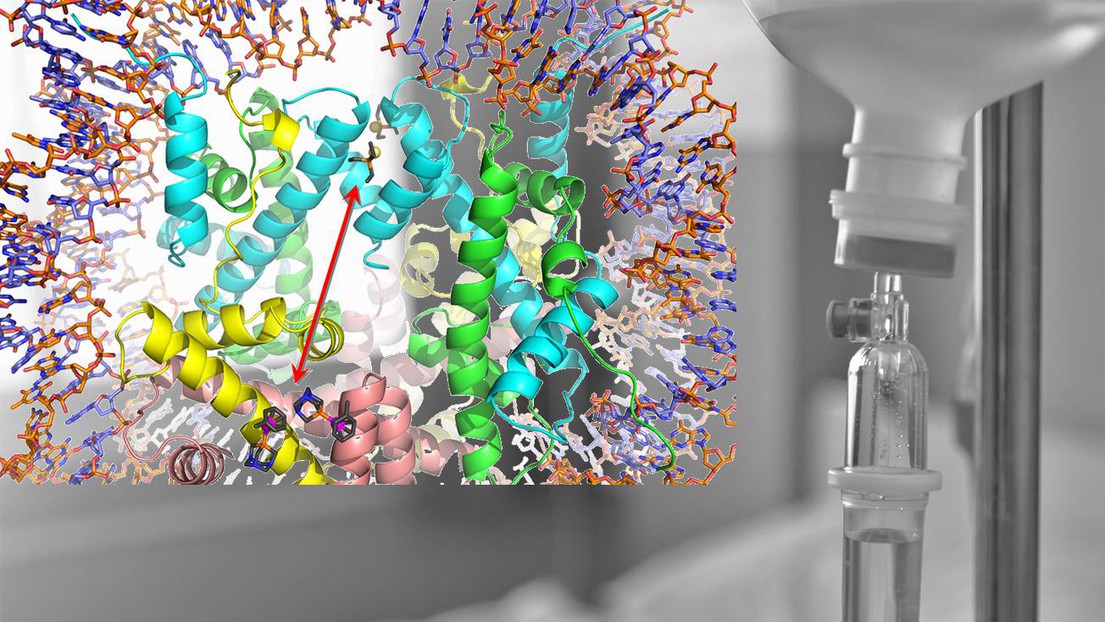
Auranofin (haut) et RAPTA-T (bas) reliant différents sites d'un nucléosome © P. Dyson / EPFL (fond: iStock)
Des scientifiques de l'EPFL et de la NTU ont découvert que la prise simultanée d’un médicament antirhumatismal renforce l'action contre les tumeurs d’un médicament anti-cancer. Cette découverte ouvre une nouvelle voie dans le domaine de la synergie entre médicaments.
L'un des objectifs de la pharmacologie est d'accroître l'efficacité des médicaments, tout en diminuant leurs effets secondaires. Cet effort a récemment conduit à combiner des médicaments sans liens entre eux pour exploiter leurs effets synergiques. Cette «synergie médicament-médicament» repose sur des interactions entre les canaux biologiques individuels par lesquels chaque médicament agit. Des scientifiques de l'EPFL et de l'université de technologie de Nanyang (NTU, Singapour) viennent de découvrir un effet synergique entre un médicament anti-cancer et un antirhumatismal, améliorant ainsi les capacités du premier à tuer les cellules cancéreuses. Ce travail est publié dans Nature Communications.
Le laboratoire de Paul Dyson et Ursula Röthlisberger à l'EPFL, en collaboration avec le laboratoire de Curtis Davey à la NTU, ont exploré les effets de synergie de deux médicaments sans liens entre eux: l'auranofine (Ridaura), un médicament contenant de l'or utilisé pour soulager les symptômes de l'arthrite rhumatoïde, et le RAPTA-T, un médicament anti-cancer contenant du ruthénium qui entrave la croissance des tumeurs comme des métastases, tout en réduisant aussi les effets secondaires de la chimiothérapie en raison de sa faible toxicité.
Bien que ces deux médicaments soient utilisés dans des conditions différentes, on a récemment découvert que l'auranofinee agissait également contre le cancer. La raison en est que, souvent, les médicaments ne se lient pas seulement en un seul site sur une molécule spécifique, mais peuvent aussi se lier à d'autres sites sans relation avec le premier et les affecter – sur la même molécule ou sur une autre. Par exemple, un médicament conçu pour se lier et activer un récepteur donné pourrait aussi se lier à une enzyme et la bloquer. Cette activité hors-site suscite fréquemment l'émergence d'effets secondaires, mais des sites de fixation médicamenteux séparés peuvent aussi agir ensemble de manière synergique d'une manière productive.
Les chercheurs ont exploré les effets synergiques des deux médicaments sur l'ADN encapsulé dans les cellules cancéreuses. En dépit des représentations courantes, les longs brins d'ADN dans la cellule passent l'essentiel de leur temps étroitement liés autour de protéines spécialisées appelées histones. Chaque fois qu'une séquence particulière, par exemple un gène, est appelée, cette section de l'ADN est déroulée et lue par la machinerie biologique appropriée.
L'étude a découvert que la combinaison des deux médicaments avait une efficacité accrue pour tuer les cellules cancéreuses, tandis qu'individuellement, les médicaments avaient un impact considérablement réduit sur la viabilité de la cellule. Lorsque le RAPTA-T est administré, il forme ce que l'on appelle des «adduits» avec les protéines histones qui encapsulent l'ADN. Ces adduits contrarient le fonctionnement normal de l'ADN et provoquent la mort de la cellule malade. L'auranofine a beaucoup moins tendance à former des adduits avec les protéines histones, sauf si les deux médicaments sont administrés ensemble.
Les chercheurs ont découvert que la liaison de l'auranofine se produit à distance, au travers d'un mécanisme allostérique à l'intérieur du nucléosome, qui contient l'ADN encapsulé de la cellule. Là, les chercheurs ont découvert que le RAPTA-T renforçait la capacité des autres médicaments à former des adduits avec les histones en se liant sur les sites d'histones distants.
Les auteurs concluent que ce mécanisme allostérique nouvellement découvert «suggère que la modulation allostérique dans les nucléosomes peut avoir une pertinence biologique et un potentiel pour des interventions thérapeutiques.»
Ce travail résulte de la collaboration entre l'Institut des sciences et ingénierie chimiques de l'EPFL et la School of Biological Sciences and Institute of Structural Biology de la Nanyang Technology University. Il a été financé par le Ministry of Health National Medical Research Council de Singapour et le Ministry of Education Academic Research Fund Tier 3 Programme, le Fonds National Suisse, et NCCR Chemical Biology.
Référence
Zenita Adhireksan, Giulia Palermo, Tina Riedel, Zhujun Ma, Reyhan Muhammad, Ursula Rothlisberger, Paul J. Dyson, Curt A. Davey. Allosteric cross-talk in chromatin can mediate drug-drug synergy.Nature Communications 30 March 2017. DOI: 10.1038/ncomms14860