Rigidifier les cellules tumorales pour une meilleure immunothérapie
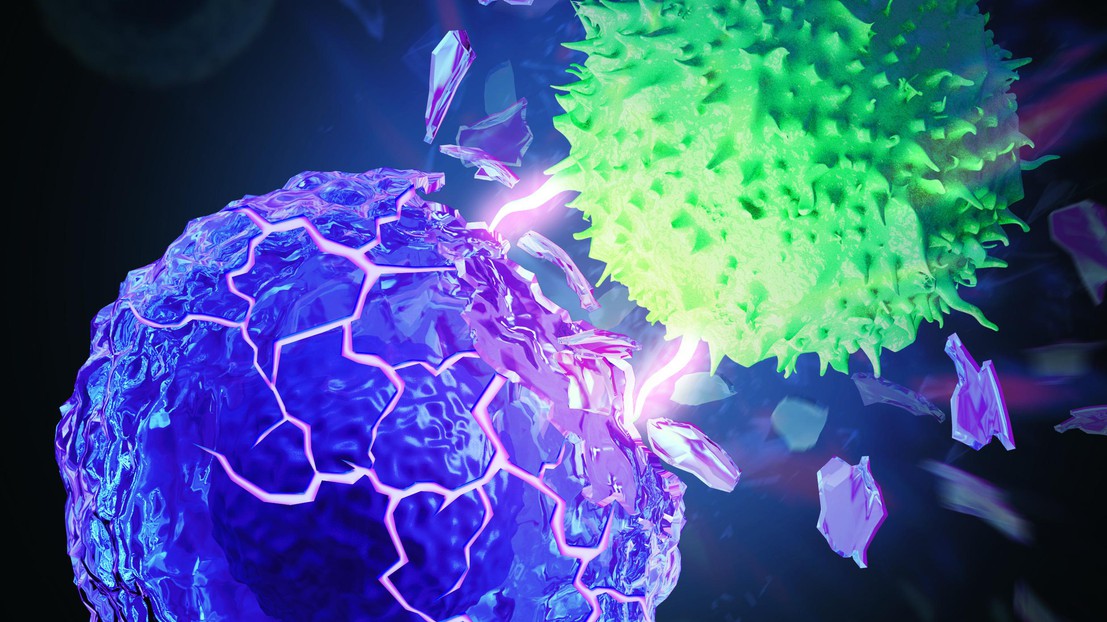
Cellule T (verte) détruisant une cellule cancéreuse rigidifiée (violette). Kewen Lei et Li Tang / 2021 EPFL et MyScimage
Des scientifiques de l’EPFL ont découvert qu’en rendant les cellules cancéreuses plus dures, l’efficacité de l’immunothérapie se trouve améliorée. Des tests précliniques ont démontré que les chances de guérison avoisinent les 50%.
Seuls 20 % des patients sont réceptifs à l’immunothérapie. Ce traitement contre le cancer prometteur qui vise à donner plus de puissance aux cellules immunitaires du corps humain, appelées cellules T, pour qu’elles combattent et détruisent les tumeurs. Les scientifiques cherchent par tous les moyens à développer de nouvelles thérapies qui puissent être combinées à l’immunothérapie afin de soigner davantage de patients. « Notre but est toujours le même : augmenter le pourcentage de patients réceptifs à l’immunothérapie. Une des raisons qui explique ce faible taux de réponse est que la maladie se montre complexe. Nous devons développer différentes approches qui, nous l’espérons, pourront se combiner entre elles », déclare Li Tang, professeur et directeur du laboratoire de biomatériaux pour l’immuno-ingénierie à la faculté des sciences et techniques de l’ingénieur de l’EPFL.

Li Tang vient d’élaborer une toute nouvelle approche basée sur la mécanique pour lutter contre le cancer. Sa recherche s’avère prometteuse puisqu’elle augmente de manière significative l’efficacité de l’immunothérapie. Sa découverte est publiée dans la revue Nature Biomedical Engineering.
Un camouflage imparable
Kewen Lei et Armand Kurum, deux doctorants du laboratoire de Li Tang, ont remarqué que la paroi des cellules cancéreuses se révèle plus molle que celles de cellules saines. « Personne ne possède d’explication à ce phénomène. Certains scientifiques supposent que cela favorise la création de métastases, mais aucun test n’a encore pu le prouver », indique Kewen Lei. Une chose est certaine, cette souplesse s’avère un mécanisme de défense pour les cellules cancéreuses. Quand une cellule T s’accroche à cellule cancéreuse afin de la détruire, sa mollesse induit en erreur la première, qui passe son chemin sans effectuer sa mission. « Il s’agit d’une technique de camouflage imparable. Lorsqu’une cellule T tue une cellule cancéreuse, elle recourt à sa force. Si la membrane de la cellule cancéreuse se trouve molle, il y a moins de résistance et cela devient plus difficile à la briser », ajoute Armand Kurum.
Un médicament anti-cholestérol contre la mollesse
Les chercheurs ne se sont pas arrêtés à cette constatation. Ils ont également identifié le responsable de cette mollesse : le cholestérol, présent dans l’enveloppe cellulaire des cellules cancéreuses. Ils ont alors mis au point un moyen de rendre les cellules cancéreuses plus rigides et plus facilement reconnaissables par les cellules T. Pour cela, ils ont eu recours un médicament contre le cholestérol couramment utilisé et l’ont combiné à une immunothérapie.

Kewen Lei, Armand Kurum et Li Tang ont ensuite testé leur nouveau cocktail de médicaments sur des souris et procédé à des expériences comparatives. « En prodiguant seulement l’immunothérapie, à terme aucun animal ne survit au cancer. Si l’on donne uniquement le remède contre le cholestérol, nous obtenons le même résultat. Cependant, en combinant les deux composants, 50 % des souris guérissent du cancer, relève Li Tang. Nous passons de zéro souris guérie à 50 %, ce chiffre est très prometteur pour la suite. » La prochaine étape de la recherche consiste à concilier cette technologie avec d’autres innovations pour booster les cellules T. Le but est d’augmenter la réceptivité des patients en combinant diverses approches.
This work was supported in part by the European Research under the ERC grant agreements MechanoIMM (805337) and ROBOCHIP (714609), Swiss National Science Foundation (Project grant 315230_173243), Swiss Cancer Research foundation (No. KFS-4600-08-2018), Kristian Gerhard Jebsen Foundation, Anna Fuller Fund Grant, and École Polytechnique Fédérale de Lausanne (EPFL). A.K. acknowledges funding from the European Union’s Horizon 2020 research and innovation program under the Marie Skłodowska-Curie grant agreement No. 754354. M.G. was supported by the Chinese Scholarship Council (CSC) (No. 201808320453).