Pourquoi la science prend du temps à passer du labo au grand public?
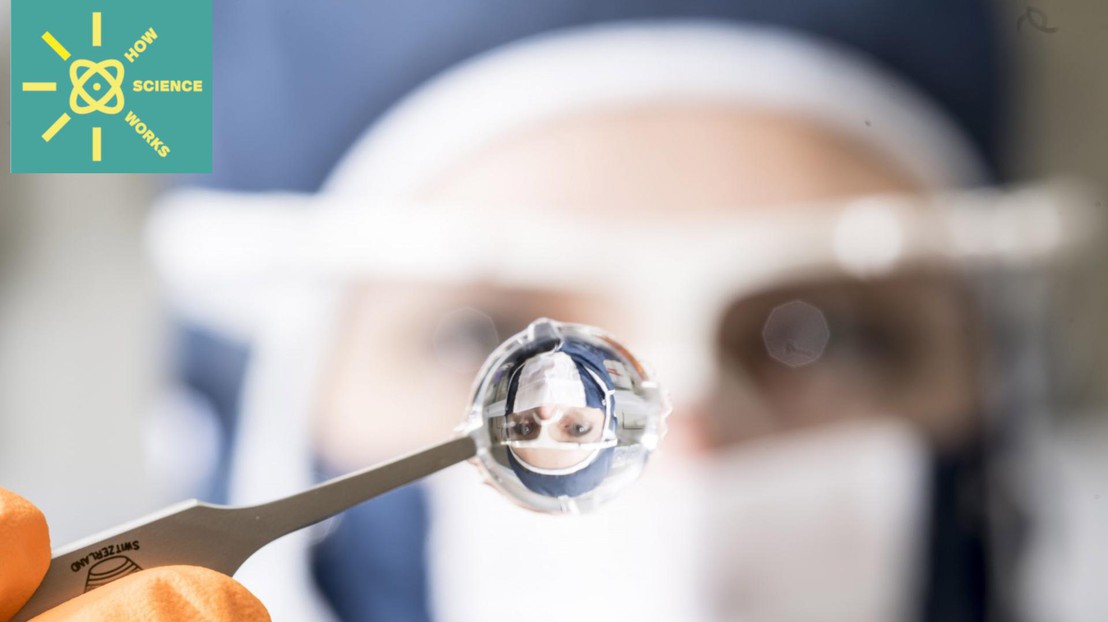
Développée depuis 2015, la prothèse rétinienne du laboratoire du prof. Diego Ghezzi est maintenant prête à être testée cliniquement. © Laboratoire LNE, EPFL
SÉRIE D’ÉTÉ: LES COULISSES DE LA SCIENCE
Pour que l’idée de base qui germe en tête du scientifique devienne réalité et utilisable par le grand public, elle doit d’abord passer par toute une série d’étapes de validation et valorisation. Aperçu.
Les résultats de recherche peuvent bien souvent produire un impact sociétal et économique. Mais même pour les recherches qui s’axent, dès le départ, vers une utilisation pratique et concrète par le public, le processus prend plusieurs années. Il aura fallu 7 ans de travail par exemple pour les pipettes intelligentes de SEED Biosciences commercialisées en 2020. «Il s’agit d’un robot pipeteur qui permet de distribuer les cellules une à une. Bien que la technologie ne soit pas d’une complexité extrême, il nous a fallu du temps pour transformer l’idée de base née en laboratoire en un produit commercial», indique Eric Meurville, cofondateur de la start-up de l’EPFL qui a ensuite rejoint l’Office de transfert de technologies de l’EPFL.
Lire aussi: Une cellule vivante déposée en un clic
À l’origine, il s’agit souvent d’un problème à résoudre. «Dans mon domaine d’activité, nous devons d’abord identifier un besoin, explique Diego Ghezzi, titulaire de la Chaire Medtronic en neuro-ingénierie de l’EPFL. À nous ensuite de proposer une solution. Dans mon laboratoire, c’est généralement une avancée technologique qui va permettre de résoudre le problème.» Depuis 2015, le professeur développe par exemple des prothèses qui se placent contre la rétine de l’œil. Ce dispositif médical vise à aider les personnes souffrant de cécité à récupérer une partie de leur vision.
Lire aussi:Une vision artificielle grâce à une prothèse rétinienne
Une fois élaborée en théorie, l’idée doit être concrétisée. En laboratoire, le dispositif est fabriqué et testé. Ses propriétés sont passées à la loupe via différentes mesures et évaluations. «Il y aura plusieurs aller-retours entre la fabrication et la caractérisation pour arriver à un dispositif qui corresponde aux attentes et qui soit optimisé. Ce qui peut durer plusieurs années», précise le chercheur.
Après cette étape de validation en laboratoire, un dispositif du domaine biomédical doit être validé au niveau biologique. «Dans notre cas, les prothèses ont été testées in vitro, sur des rétines animales dans un premier temps, poursuit-il. Et dans un second temps, en in vivo sur des organismes vivants. Tout ceci avec l’approbation des autorités cantonales bien sûr.»
Répétitions et vérifications par les pairs
Pour s’assurer que le résultat soit fiable et pas dû au hasard, les expériences sont répétées. Lors d’évaluations quantitatives des performances, plusieurs dizaines de reproductions sont nécessaires. Ce nombre est dicté par des règles statistiques et dépend de multiples variables.
Tout au long du processus, le chercheur va être amené à partager ses découvertes avec ses pairs. Au travers d’échange durant des conférences et par le biais de publications, ils peuvent recevoir des conseils ou critiques qui feront avancer leur recherche. Une validation scientifique a également lieu lorsqu’un article décrivant les travaux de recherche est publié dans une revue scientifique. Des experts du domaine abordé dans le papier relisent et commentent le texte, qui peut ensuite être modifié par son auteur. Pour être publié, l’article doit être approuvé par ces experts.
Mise sur le marché
Pour être commercialisé, le dispositif doit ensuite passer par des étapes de validation par des organismes externes au monde de la recherche. Deux voies de valorisation sont alors possibles: la cession de licence à une entreprise établie ou la création d’une start-up, si le scientifique se sent l’âme d’un entrepreneur.
«À l’EPFL, le chercheur est accompagné dans les deux cas. D’une part via le programme enable, qui fournit un financement et une expertise aux scientifiques afin que leurs innovations atteignent rapidement un niveau de maturité tel qu’elles suscitent l’intérêt de partenaires industriels, en Suisse ou à l’étranger. D’autre part avec la Startup Unit, qui offre un accompagnement avec du coaching ou des financements notamment», détaille Eric Meurville.
Généralement, on présente un prototype à des clients potentiels et investisseurs qui doivent être convaincus de la pertinence du produit pour combler un besoin du marché ou de son avantage concurrentiel sur ce qui existe déjà.
Essais cliniques
Pour un dispositif médical, il convient de réaliser un essai clinique dont le but est de démontrer que celui-ci est sûr et efficace chez l’humain. Mais pour y être éligible, il faut effectuer de nouveaux tests de sécurité dans des conditions qui respectent les bonnes pratiques de fabrication, un niveau de contrôle qui n’est pas pratiqué dans la version de laboratoire du dispositif. Si Swissmedic, l’autorité d’autorisation et de surveillance des produits thérapeutiques en Suisse, en donne l’autorisation, un premier essai clinique généralement sur 1 à 5 patients et dans un seul hôpital peut se faire. S’en suit un essai clinique de plus grande envergure, avec plusieurs hôpitaux et plusieurs dizaines de patients.
Vient ensuite l’étape de la certification. Pour être vendu en Europe, un produit doit avoir un marquage CE; pour être vendu aux États-Unis, un marquage FDA est requis. Il indique qu'un produit a été évalué par le fabricant et qu'il a été jugé conforme aux exigences en matière de sécurité, de santé et de protection de l'environnement.
Vous l’aurez compris, pour que la science passe du laboratoire au grand public, la route est longue. «Ce temps dépend naturellement de la complexité du produit ou service, et de son domaine d’utilisation. Il est par exemple beaucoup plus long pour un dispositif médical implantable ou un médicament, déclare Eric Meurville. Pour avoir davantage de chances de succès, il faut que le produit arrive à temps sur le marché et que dès lors, il réponde encore à un besoin non satisfait!»
Série d'été: Dans les coulisses de la science
A lire aussi: "Les non-scientifiques à la rescousse de la recherche"

