La forme guide la croissance des organoïdes
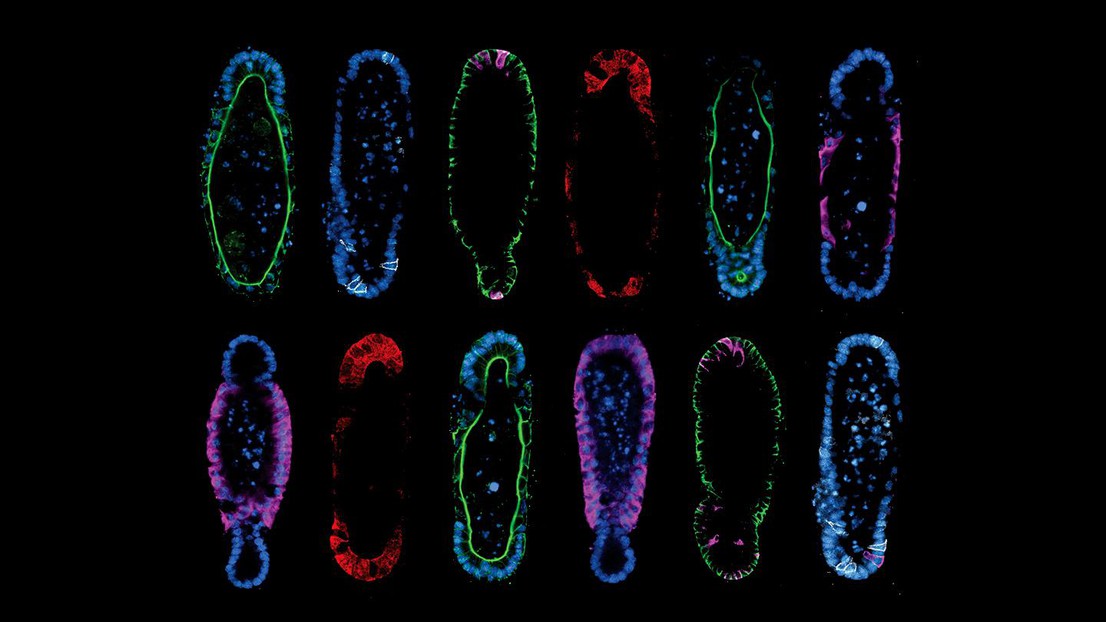
La géométrie des tissus contrôle la structuration des organoïdes. Crédit: Mike Nikolaev (EPFL).
Cultivés en laboratoire, les organoïdes sont des structures tissulaires miniatures qui peuvent reproduire les organes. Mais il est difficile de guider les cellules souches pour qu’elles développent un organoïde de forme et de taille définies. Aujourd’hui, des bioingénieurs de l’EPFL ont mis au point de nouvelles méthodes pour guider les cellules souches dans la formation de tissus intestinaux présentant une fonction et une structure 3D réelles.
Avec la capacité de cultiver des organes miniatures fonctionnels en laboratoire, un nouveau chapitre de l’évolution de la bioingénierie s’écrit. Les applications sont nombreuses: essais sur médicaments sûrs, modélisation des maladies, diminution de l’utilisation d’animaux et nouvelles connaissances en biologie humaine figurent en tête de liste. Et même si le chemin à parcourir est encore long, l’évolution des modèles d’organes cultivés en laboratoire a déjà permis des avancées remarquables.
Les organoïdes en font partie: il s’agit d’organes miniatures cultivés à partir de cellules souches à l’intérieur d’hydrogels spécialisés. Créé il y a plus de dix ans, le domaine des organoïdes a progressé à un rythme impressionnant. Toutefois, il reste confronté à plusieurs défis majeurs: par exemple, il est actuellement impossible de contrôler le développement des cellules souches en organoïde.
Les douleurs de croissance
Le simple fait d’ajouter des cellules souches dans un hydrogel et de les laisser agir entraîne la formation plutôt aléatoire («stochastique» est le terme technique) de colonies de cellules. Même si des unités structurelles importantes, comme les glandes intestinales, sont présentes dans les organoïdes conventionnels, les chercheuses et chercheurs n’ont aucun contrôle sur le moment et l’endroit où ces unités se forment ni sur leur nombre. Pouvoir contrôler ces aspects est une condition préalable à la création de modèles in vitro qui ressemblent à des organes réels et fonctionnent comme tels.
Alors, peut-on contrôler la croissance et la structure des organoïdes? Cette question est à l’origine des recherches menées par Matthias Lütolf et son équipe de la Faculté des sciences de la vie de l’EPFL. Leurs travaux ont montré que des facteurs externes tels que la rigidité de l’environnement peuvent avoir d’importantes répercussions sur la biologie des organoïdes.
Une histoire de rigidité
En 2016, le laboratoire de Matthias Lütolf a publié un article révolutionnaire expliquant que la rigidité de l’hydrogel peut influencer le développement et la croissance des organoïdes à différentes étapes du processus. En 2020, son équipe a publié un article sur le développement réussi d’organoïdes intestinaux miniatures cultivés dans des micropuces, ce qui a ouvert de nouvelles perspectives pour la modélisation de maladies humaines complexes.
«En contrôlant la formation des organoïdes et les structures obtenues, nous pourrions non seulement comprendre les mécanismes morphogénétiques sous-jacents, mais aussi concevoir des modèles d’organes miniatures qui ressemblent davantage à leurs homologues réels», explique Matthias Lütolf. «Puisque les architectures fonctionnelles finales des organes découlent de l’interaction entre l’auto-organisation cellulaire et le contrôle micro-environnemental extrinsèque, nous devons tenir compte de ces deux paramètres.»
La fonction suit la forme
En suivant ce raisonnement, Nikolce Gjorevski et Mike Nikolaev, deux anciens membres de l’équipe de Matthias Lütolf, se sont efforcés de trouver des moyens de contrôler le développement autrement stochastique des organoïdes. Leurs travaux aboutissent aujourd’hui à une nouvelle étude qui présente des méthodes permettant de contrôler le développement d’organoïdes qui ressemblent de plus en plus à des organes in vivo. Cette étude est publiée dans la revue Science.
La méthode décrite par l’équipe s’articule autour de deux principes. Tout d’abord, les chercheuses et chercheurs ont découvert qu’en partant d’une forme initiale d’organoïde reproductible, on obtient un développement reproductible, ce qui résout le problème de la variabilité des organoïdes.
Ensuite, ils ont constaté que la conception d’organoïdes qui ont la même forme que l’organe réel les aide à adopter une composition et une fonction cellulaires semblables à celles d’un organe. Par exemple, si l’on cultive des cellules souches sous la forme d’une glande intestinale, elles s’organiseront et fonctionneront comme une crypte. Le paradigme selon lequel «la forme suit la fonction» est un fondement de la biologie, mais l’étude a révélé que le contraire était également vrai.
Quoi qu’il en soit, Nikolce Gjorevski et Mike Nikolaev ont également dû élaborer des stratégies pour le paradigme réel. À l’aide d’une technologie nommée «micromodélisation», ils ont façonné en interne les hydrogels qui abriteront les organoïdes. Le remplissage de cellules souches dans des cavités d’hydrogel conçues avec précision a finalement donné lieu à des organoïdes qui se sont adaptés à la forme des cavités préformées. La procédure n’est pas sans rappeler celle de la sculpture classique sur métal, qui consiste à couler du métal en fusion dans un moule et à le laisser se solidifier pour obtenir une forme prédéfinie.

La croissance réussie d’un organoïde
Les résultats parlent d’eux-mêmes. En modifiant la forme de l’hydrogel pour qu’il corresponde à l’anatomie de l’intestin, les chercheuses et chercheurs ont pu guider les cellules souches pour qu’elles se développent en tissus épithéliaux avec une crypte et des villosités («pics et vallées») réalistes. Cela est particulièrement important, car une grande partie de la fonctionnalité de l’intestin dépend des différentes populations de cellules résidant dans ces structures.
Par exemple, les cryptes sont l’endroit où se trouvent les cellules de Paneth de l’intestin. Ce sont des cellules sécrétoires qui jouent un rôle important dans le maintien des cellules souches et dans la défense immunitaire de l’épithélium intestinal. Grâce à l’approche adoptée par l’équipe de Matthias Lütolf, les cellules de Paneth apparaissent uniquement dans les cavités de la crypte, tout en produisant les différentes cellules du tissu intestinal dans tous les emplacements anatomiques appropriés.
«Notre méthode s’est avérée efficace pour guider l’organogénèse à partir de cellules souches», déclare Matthias Lütolf, qui dirige aujourd’hui l’Institut de bioingénierie translationnelle (ITB) de Roche. «Nos cultures d’organoïdes peuvent apporter des réponses à des questions que les modèles existants – y compris les animaux – ne peuvent pas résoudre. Elles peuvent également contribuer à appliquer la technologie des organoïdes dans le monde réel.»
Liste des autres contributeurs
- Université du Colorado à Boulder
- Laboratoires Sandia
- Institut Friedrich Miescher pour la recherche biomédicale (FMI)
Fonds national suisse de la recherche scientifique (SNSF)
Projet Horizon 2020 INTENS de l’UE
PHRT - Proposition de projet de recherche PM/PH 2017
EPFL
National Institutes of Health (NIH)
Bourse de post-doctorat de longue durée de l’EMBO
Fonds national de la recherche scientifique (NSF)
Center for Integrated Nanotechnologies
N. Gjorevski, M. Nikolaev, T.E. Brown, O. Mitrofanova, N. Brandenberg, F.W. DelRio, F. M. Yavitt, P. Liberali, K.S. Anseth, M.P. Lütolf. Tissue geometry drives deterministic organoid patterning. Science 07 January 2022. DOI: 10.1126/science.aaw9021