Immunothérapie du cancer: viser les vaisseaux sanguins
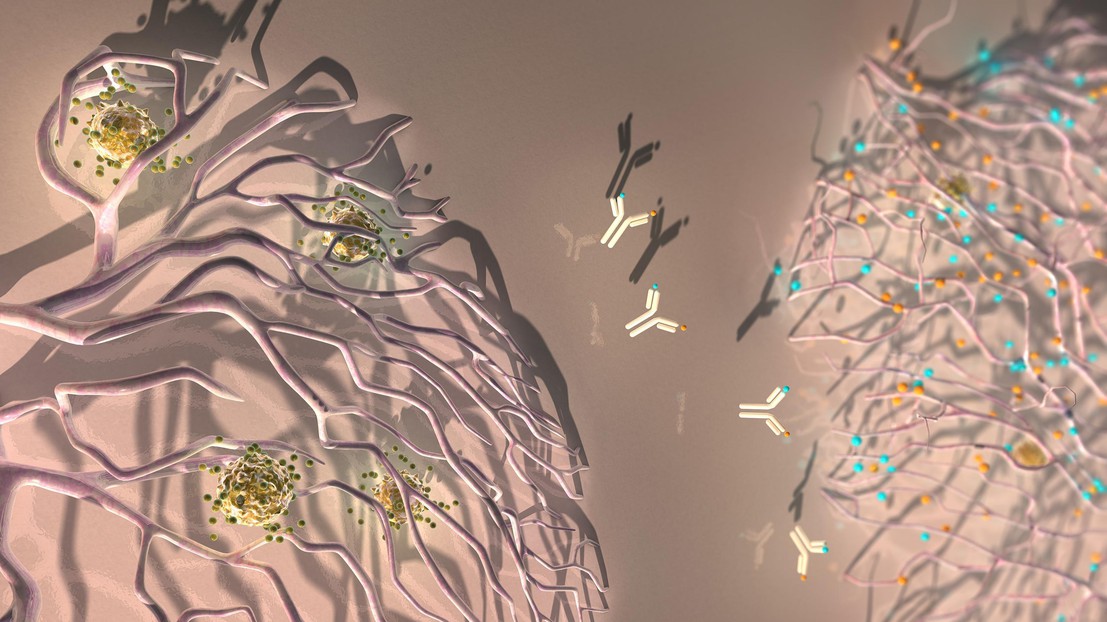
Un anticorps contre ANGPT2 et VEGFA reprogramme les vaisseaux sanguins d'une tumeur pour faciliter l'extravasation de cellules T anti-tumorales. (Ella Maru Studio)
Des scientifiques de l'EPFL ont amélioré l'efficacité de l'immunothérapie du cancer en bloquant deux protéines qui régulent la croissance des vaisseaux sanguins des tumeurs.
L'immunothérapie du cancer vise à renforcer ou à restaurer la capacité du système immunitaire du patient – les lymphocytes T, ou cellules T – à reconnaître et attaquer le cancer. Mais les tumeurs mettent en œuvre plusieurs stratégies pour contrer les attaques immunitaires, ce qui limite l'efficacité de l'immunothérapie à une minorité de patients seulement. Par exemple, elles produisent des vaisseaux sanguins qui bloquent l'arrivée des lymphocytes T, plutôt que de la faciliter. Des scientifiques de l'EPFL viennent d'améliorer l'efficacité de l'immunothérapie contre différents types de cancers en reprogrammant les vaisseaux sanguins de la tumeur. L'étude est publiée dans Science Translational Medicine et elle figure en couverture de la revue.
Affamer les tumeurs
Pour la tumeur, les vaisseaux sanguins sont indispensables pour fournir de l'oxygène et des nutriments aux cellules cancéreuses qui se développent. Le laboratoire de Michele de Palma à l'EPFL a mis l'accent sur deux protéines, appelées VEGFA et ANGPT2, que les tumeurs génèrent pour stimuler la croissance de nouveaux vaisseaux sanguins. Le fait de bloquer l'activité de ces protéines peut freiner la croissance des vaisseaux sanguins, limiter l'approvisionnement en oxygène et en nutriments, et affamer la tumeur.
Afin de bloquer ces protéines, les scientifiques de l'EPFL ont utilisé un anticorps nommé A2V. L'équipe a testé A2V sur des modèles expérimentaux de cancer du sein, du pancréas, et sur des mélanomes. Ils ont découvert qu’il offre des bénéfices thérapeutiques certains, alors que les anticorps qui bloquent soit VEGFA, soit ANGPT2 individuellement, ont une efficacité plus limitée. A2V bloque également les métastases, une occurrence qui est souvent fatale chez des patients cancéreux.
Reprogrammer les vaisseaux sanguins de la tumeur
Sous l'influence de VEGFA et d'ANGPT2, les vaisseaux sanguins de la tumeur acquièrent aussi une structure aberrante qui entrave le passage des lymphocytes T, limitant ainsi l'efficacité de l'immunothérapie. A2V a provoqué la régression de nombreux vaisseaux sanguins de la tumeur, mais certains ont persisté après la thérapie.
«Une découverte intéressante a été que A2V a non seulement réduit la plupart des vaisseaux sanguins de la tumeur, mais encore qu'il a inversé les structures aberrantes de ceux qui subsistaient, ce qui les a rendus semblables à des vaisseaux sanguins normaux, et plus perméables à l'arrivée de lymphocytes T anti-tumoraux», dit De Palma. De fait, A2V favorise une «extravasation» des lymphocytes T dans les tumeurs, un processus nécessaire pour initier une réponse immunitaire contre la tumeur.
Un anticorps utile
Les tumeurs peuvent éviter d'être détectées en surveillant les cellules immunitaires, telles que les lymphocytes T. Les tumeurs y parviennent en exprimant certaines protéines, nommées «ligands des checkpoints immunitaires». Une de celles-ci est la protéine PD-L1 (programmed death ligand 1), qui lie un récepteur (PD-1) présent à la surface des cellules T, les empêchant ainsi d'attaquer la tumeur. Un moyen de contourner ce problème consiste à utiliser des médicaments appelés inhibiteurs de checkpoint. Ce sont habituellement des anticorps qui trouvent et lient les protéines de checkpoint immunitaire sur les tumeurs, les ouvrant ainsi aux attaques immunitaires.
Les chercheurs de l'EPFL ont découvert que l'accumulation de cellules T activées autour des vaisseaux sanguins de la tumeur, déclenchée par la thérapie A2V, entraînait également une réponse défensive: les vaisseaux sanguins ont commencé à produire le ligand de checkpoint PD-L1, dans un effort pour aveugler les lypmhocytes T qui attaquaient. Cependant, les chercheurs ont établi qu'il était possible de surmonter cet obstacle en bloquant le récepteur PD-1. De fait, un anticorps anti-PD-1 a encore renforcé les effets anti-tumoraux de A2V.
«Ces données nous rappellent que des mécanismes de résistance aux thérapies anti-cancer sont toujours à l'affût. Tandis que A2V normalisait les vaisseaux sanguins de la tumeur et facilitait l'arrivée des cellules T anti-tumorales, les cellules T anti-tumorales ont été rapidement éliminées lors de leur extravasation au micro-environnement de la tumeur», dit De Palma.
Cette étude a des implications importantes pour l'immunothérapie du cancer. «Nos travaux suggèrent que certains médicaments anti-angiogéniques, en particulier les inhibiteurs ANGPT2, ont des effets plus considérables sur les tumeurs que ce que l'on pensait initialement. En plus de cibler les vaisseaux sanguins, ils aident aussi à initier les réponses immunitaires anti-tumorales, ce qui peut être renforcé par le blocage du checkpoint immunitaire.»
Ce travail a impliqué des contributions des Roche Innovation Centers à Bâle et Munich. Il a été financé principalement par la Fondation Leenaards, la Ligue suisse contre le cancer, la Fondation San Salvatore, et Roche.
Référence
Martina Schmittnaegel, Nicolò Rigamonti, Ece Kadioglu, Antonino Cassará, Céline Wyser Rmili, Anna Kiialainen, Yvonne Kienast, Hans-Joachim Mueller, Chia-Huey Ooi, Damya Laoui, Michele De Palma. Dual angiopoietin-2 and VEGFA inhibition elicits anti-tumor immunity that is enhanced by PD-1 checkpoint blockade.Sci. Transl. Med. 9, eaak9670 (12 April 2017). DOI: 10.1126/scitranslmed.aak9670