Des tissus embryonnaires sur une puce
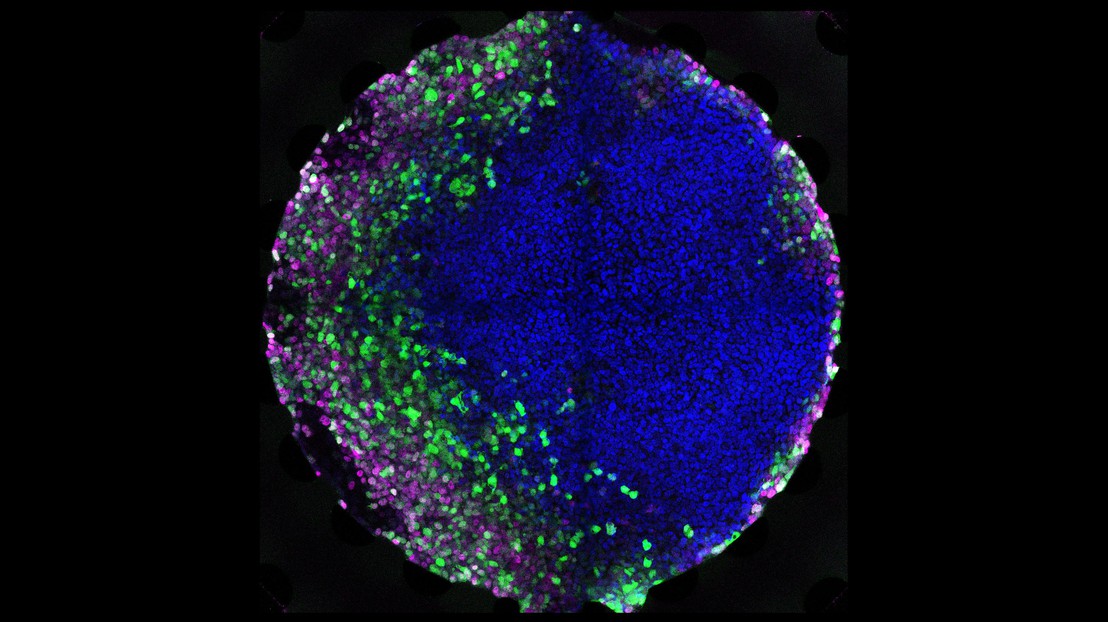
Des cellules souches embryonnaires humaines exposées à un gradient microfluidique d'un morphogène, entraînant l'établissement de différents types de cellules. Crédit: Andrea Manfrin (EPFL)
Des chercheurs de l'EPFL ont mis au point une méthode pour stimuler les cellules souches humaines à s'organiser en couches ordonnées de différents types de cellules. Publiée dans Nature Methods, cette recherche est basée sur la microfluidique et peut aider à comprendre comment les tissus sont formés dans l'embryon, ouvrant la voie à la fabrication de tissus et d'organes fonctionnels pour les tests de médicaments et les transplantations.
L'utilisation d'embryons humains pour la recherche biologique et médicale suscite de nombreuses préoccupations éthiques. Bien qu'il faille faire preuve de prudence dans ces domaines, il serait toutefois avantageux pour la science de pouvoir étudier la biologie humaine avec plus d'exactitude.
Une solution réside dans l'utilisation d'outils alternatifs - ce que les scientifiques appellent les modèles in vitro. Cependant, malgré les progrès réalisés avec les tissus adultes, lorsqu'il s'agit de modéliser le développement de l'embryon humain, les choses deviennent compliquées.
Aujourd'hui, des scientifiques de l'Institut interfacultaire de Bioingénierie de l'EPFL ont simulé des aspects de la formation embryonnaire in vitro à partir de cellules souches embryonnaires.
"Un problème délicat dans la construction fiable de tissus en dehors d'un organisme est de savoir comment présenter des molécules de signalisation clés, également appelées morphogènes, aux cellules en culture au bon moment et à la bonne dose ", explique le professeur Matthias Lütolf de l'EPFL, dont le groupe a dirigé la recherche. "Le simple fait d'exposer une collection de cellules souches à une seule concentration d'un morphogène aboutit à une morphogenèse incontrôlée, car les cellules sont privées d'instructions importantes."
Mais dans un embryon en développement, les cellules souches reçoivent une gamme très dynamique de concentrations morphogéniques de ce qu'on appelle des "centres de signalisation". C'est ce gradient de morphogènes qui indique aux cellules souches quel type de cellules et de tissus spécialisés elles doivent devenir.
Pour appliquer ce principe, le Dr Andrea Manfrin, du laboratoire de Matthias Lütolf, a mis au point une méthode pour exposer les cellules souches embryonnaires humaines en culture à des gradients de morphogènes, imitant les conditions réelles de la gastrulation - un stade précoce du développement embryonnaire où les cellules commencent à se transformer en différents types et tissus.
La méthode consiste à cultiver les cellules souches dans un dispositif microfluidique, qui est une puce munie de petits canaux qui permettent le contrôle précis de petites quantités de liquide. Les chercheurs ont cultivé des cellules souches dans une chambre de culture sur la puce microfluidique et ont pu les exposer à des gradients de concentration soigneusement contrôlés de divers morphogènes.
Les résultats ont été impressionnants : les cellules se sont développées et organisées en domaines de différents types de cellules, selon la concentration à laquelle elles ont été exposées, comme elles le font dans le corps. En fait, les scientifiques rapportent qu'ils ont réussi à imiter certains aspects de la gastrulation, ouvrant la voie à la culture de tissus humains spécifiques en laboratoire d'une manière plus contrôlée.
"Nous avons émis l'hypothèse que réaliser un centre de signalisation artificiel 'ex vivo' pourrait nous permettre d'orienter l'auto-organisation d'une population de cellules souches vers un résultat souhaité ", explique Andrea Manfrin. "Cela présente des avantages évidents pour la création de tissus et d'organes."
Ces avancées permettraient de nouveaux outils pour le dépistage des médicaments et la médecine régénérative. Cette nouvelle technique peut également aider les scientifiques à étudier les processus liés à la biologie du développement - comme la gastrulation - et pourrait fournir des alternatives à l'expérimentation animale dans certains domaines de recherche.
L'un de nos objectifs à long terme est de créer des organes destinés à la transplantation", explique Matthias Lütolf, qui travaille déjà notamment avec des groupes du CHUV pour produire des organes miniaturisés ("organoïdes") à partir de cellules issues de patients. "Nous sommes encore loin de cultiver des organes fonctionnels en laboratoire, mais les progrès récents de la biologie des cellules souches et de la bio-ingénierie me rendent optimiste quant à la possibilité que cela devienne une réalité. La clé est de mieux comprendre comment les cellules elles-mêmes construisent les tissus et les organes dans l'embryon".
Horizon 2020 (“EPFL Fellows”), Canadian Institute of Health Research, SystemsX.ch Transition Postdoc Fellowship and StoNets, EU Framework 7 (Plurimes), Swiss National Science Foundation, ETH Board Personalized Health and Related Technologies Initiative, EPFL
Andrea Manfrin, Yoji Tabata, Eric R. Paquet, Ambroise R. Vuaridel, François R. Rivest, Felix Naef, Matthias P. Lutolf. Engineered signaling centers for the spatially controlled patterning of human pluripotent stem cells. Nature Methods 27 June 2019. DOI: 10.1038/s41592-019-0455-2