Des petites molécules jouent un rôle stabilisateur clé
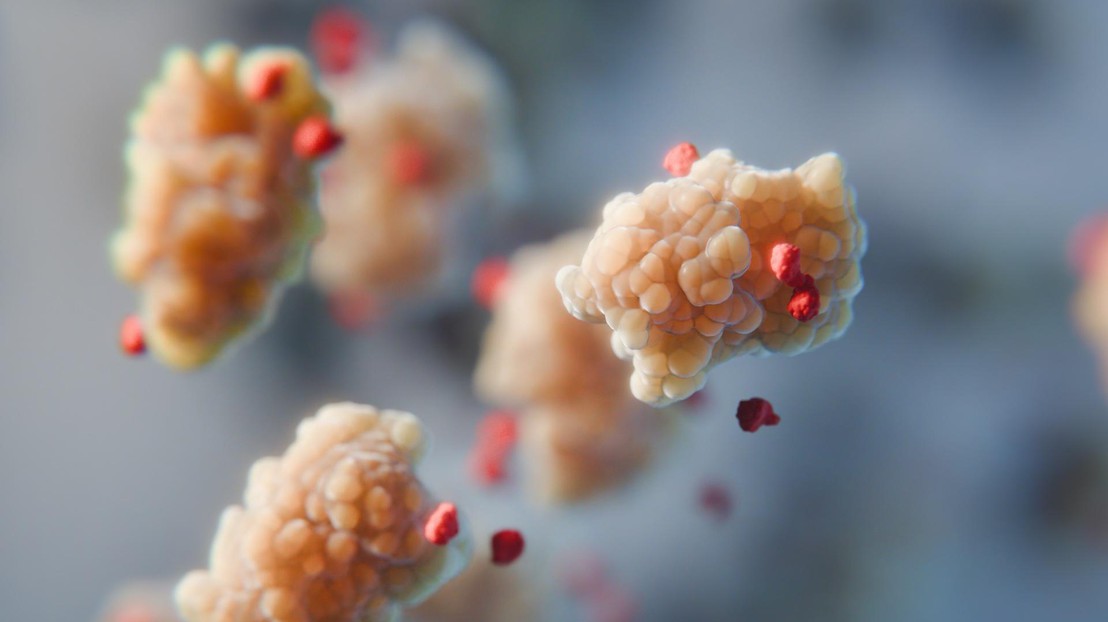
Des acides aminés (en rouge) «filtrent» l’attraction des protéines (en jaune) vers d’autres molécules. 2025 SuNMIL EPFL CC BY SA
Les acides aminés peuvent aider à stabiliser les protéines, par exemple en tant qu’additifs aux formulations pharmaceutiques. En essayant de comprendre pourquoi, des scientifiques de l’EPFL et du MIT ont découvert un effet stabilisateur fondamental de toutes les petites molécules, une propriété intéressante pour contrôler les particules dans une solution.
Depuis des décennies, des acides aminés sont ajoutés à des formules médicales, pare exemple comme stabilisateurs dans l’insuline. Ces petites molécules empêchent les protéines (c’est-à-dire les particules plus grosses) d’interagir de manière indésirable. Depuis des décennies, les scientifiques savent que cela fonctionne – mais ils ignorent pourquoi.
Une équipe internationale, dirigée par le Laboratoire des nanomatériaux et interfaces supramoléculaires de la Faculté des sciences et techniques de l’ingénieur de l’EPFL, explique enfin ce phénomène et montre un effet stabilisateur fondamental de toutes les petites molécules en solution. Cette découverte, en collaboration avec le MIT (Alfredo Alexander-Katz) et la Southern University of Science and Technology en Chine (Zhi Luo, ancien élève de l’EPFL), est publiée dans Nature.
«Lorsqu’elles sont en suspension dans une solution, les protéines changent constamment de forme autour d’une configuration centrale. La théorie dominante est donc que les acides aminés empêchent le mauvais pliage des protéines», explique Ting Mao, récemment titulaire d’un doctorat à l’EPFL et principale autrice.
«Notre étude montre que ce n’est pas le cas. En fait, l’effet stabilisateur des acides aminés n’a pas grand-chose à voir avec la biologie, mais est plutôt une propriété générale de toutes les petites molécules par rapport aux particules plus grosses, appelées colloïdes, dans une solution.»
Équilibrer l’attraction et la répulsion
Pour comprendre cet effet colloïdal des petites molécules, Francesco Stellacci, chef du Laboratoire des nanomatériaux et interfaces supramoléculaires, prend l’image de deux collègues marchant l’un vers l’autre dans un couloir.
«Supposons que ces deux collègues s’entendent très bien et veulent toujours s’arrêter pour discuter. Si le couloir est vide, ils se repéreront immédiatement et se rejoindront. Mais si le couloir est bondé, il se peut qu’ils ne se voient pas avant d’être passés l’un devant l’autre, voire qu’ils se manquent complètement», détaille Francesco Stellacci. «Ce phénomène, appelé l’attraction par filtrage, est la manière dont les acides aminés affectent les plus grosses particules: ils jouent le rôle de la foule dans le couloir, décourageant les interactions de passage et évitant les discussions de couloir impromptues.»
Notre objectif ultime est de prédire quelles molécules peuvent stabiliser quelles protéines et en quelle quantité – ce qui est actuellement fait par tâtonnements dans la recherche biomédicale.
Depuis plus d’un siècle, les scientifiques connaissent l’effet inverse des sels : ils filtrent la répulsion. Dans l’exemple du couloir, le sel joue également le rôle de la foule, mais, dans ce cas, il empêche deux collègues inamicaux d’éviter une interaction gênante.
«Nous avons découvert que les acides aminés sont en fait de l’anti-sel, car ils ont un effet de filtrage inverse. On peut même le voir dans la nature: il a été démontré que, lorsqu’une plante est arrosée avec de l’eau salée, ses cellules produisent plus d’acides aminés pour aider à les stabiliser lorsqu’elles sont stressées par l’augmentation de la concentration de sel», indique Quy Ong, chercheur de l’EPFL et coauteur.
Meilleur contrôle des interactions moléculaires
Ces travaux plaident en faveur de la déclaration des concentrations d’acides aminés dans les études scientifiques à venir, estiment les chercheuses et chercheurs. «En biologie, on ne ferait jamais une expérience sans indiquer la concentration ionique (sel) d’une solution. Nos travaux montrent que les concentrations d’acides aminés ont tout autant d’impact et doivent donc être rapportées de manière tout aussi rigoureuse», précise Francesco Stellacci.
En effet, le professeur met déjà à profit le potentiel inexploité de ces effets moléculaires dans le cadre de la subvention ERC Advanced Grant qu’il vient de recevoir. «Nous voulons comprendre comment de petites molécules comme les acides aminés sont essentielles à une fonction biologique saine. Avec le soutien de notre fonds ERC, notre objectif ultime est de prédire quelles molécules peuvent stabiliser quelles protéines et en quelle quantité – ce qui est actuellement fait par tâtonnements dans la recherche biomédicale.»
Mao, T., Xu, X., Winkler, P.M. et al. Stabilizing effect of amino acids on protein and colloidal dispersions. Nature (2025). https://doi.org/10.1038/s41586-025-09506-w