Des peptides à prendre sous forme de pilules
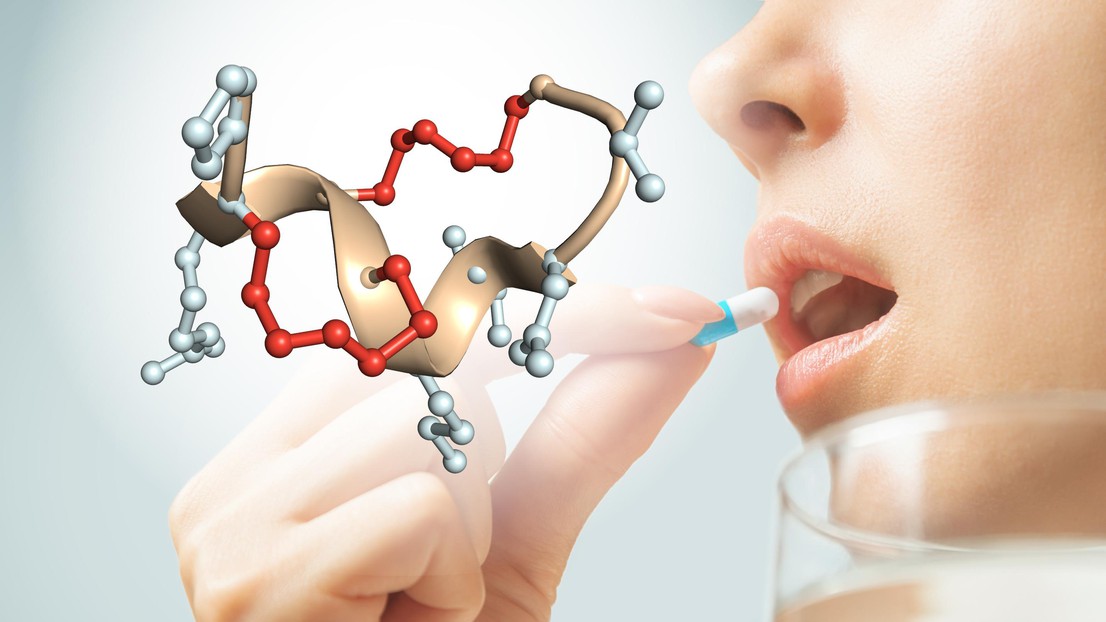
Structure d’un peptide à double pontage qui résiste à la dégradation enzymatique dans l’estomac et les intestins. Crédit: C. Heinis
Les peptides représentent un marché d’un milliard de dollars dans l’industrie pharmaceutique, mais ils ne peuvent généralement être pris que par injection pour ne pas être dégradés par les enzymes de l’estomac. Des scientifiques de l’EPFL ont désormais mis au point une méthode permettant de créer des peptides qui résistent à la dégradation enzymatique et peuvent être pris par voie orale.
Les peptides sont de petites chaînes d’acides aminés que l’on trouve dans notre corps, des plantes et des bactéries, où ils remplissent diverses fonctions. Plusieurs peptides sont utilisés comme médicaments, notamment l’insuline, qui régule le métabolisme du sucre, et la ciclosporine, qui empêche le rejet d’un organe après sa transplantation. Plus de 40 peptides sont déjà homologués comme médicaments, et ils génèrent des recettes qui se chiffrent en milliards. Actuellement, plusieurs centaines de traitements à base de peptides font l’objet d’essais cliniques.
Toutefois, quasiment aucun de ces peptides médicamenteux ne peut être pris par voie orale. En effet, comme ces chaînes constituent une part importante de la nourriture, l’estomac et les intestins abritent d’innombrables enzymes capables de les dégrader. Cela implique que la majorité des médicaments à base de peptides ne résistent pas au passage par le tube digestif.
Les peptides «cycliques», dont les extrémités sont reliées par des ponts chimiques, ont laissé espérer l’obtention d’une meilleure stabilité que ce que présentent leurs homologues linéaires: comme leur squelette est moins flexible, ils sont plus difficiles à attaquer pour les enzymes. En 2018, le groupe de recherche de Christian Heinis à l’EPFL a mis au point un nouveau format de peptides appelés «peptides à double pontage», qui sont cyclisés par deux ponts chimiques leur conférant une stabilité encore meilleure. Malgré cette réussite, la plupart de ces peptides n’étaient toujours pas assez stables pour survivre à l’énorme pression enzymatique qui règne dans le tractus gastro-intestinal.
Le groupe de Christian Heinis a désormais élaboré une nouvelle méthode pour identifier parmi des milliards de peptides à double pontage ceux qui se lient à une cible pathologique et résistent aux enzymes du tube digestif. Cette méthode, qui a fait l’objet d’un article dans Nature Biomedical Engineering, comporte trois étapes.
D’abord, des milliards de séquences peptidiques aléatoires encodées génétiquement sont cyclisées par deux ponts chimiques qui imposent des contraintes conformationnelles au squelette des peptides, ce qui les rend plus difficiles à attaquer pour les enzymes.
Ensuite, les peptides de cette bibliothèque sont exposés à des enzymes provenant de l’intestin d’une vache afin d’éliminer ceux qui ne sont pas stables.
Troisième et dernière étape, les scientifiques trempent des protéines cibles dans les peptides survivants pour récupérer ceux qui se lient à la cible pathologique en question. «C’est un peu comme chercher une aiguille dans une botte de foin, et cette méthode rend cela facile», explique Christian Heinis.
Grâce à cette méthode, les chercheurs sont parvenus pour la première fois à élaborer des peptides qui visent des cibles spécifiques et résistent à la dégradation dans le tractus gastro-intestinal. Par exemple, ils ont administré à des souris un peptide principal qui inhibe la thrombine, une cible antithrombotique importante, sous forme de pilule. Le peptide est resté intact dans l’estomac et les intestins, et même si les quantités qui sont parvenues dans le flux sanguin étaient plutôt faibles, la majeure partie était complètement intacte après avoir traversé l’ensemble du tube digestif. C’est là une étape clé en vue de concevoir des médicaments peptidiques à prendre par voie orale.
Le groupe de Christian Heinis applique désormais cette nouvelle méthode pour mettre au point des peptides oraux qui agissent directement sur des cibles gastro-intestinales, c’est-à-dire qui n’ont pas besoin d’entrer dans le flux sanguin. «Nous nous concentrons sur des maladies inflammatoires chroniques du tract gastro-intestinal telles que la maladie de Crohn, la colite ulcéreuse ainsi que des infections bactériennes, précise Christian Heinis. Nous sommes déjà parvenus à générer des peptides résistants aux enzymes contre le récepteur de l’interleukine-23, une source importante de ces maladies, qui affectent des millions de patients dans le monde entier et contre lesquelles aucun médicament oral n’est disponible.»
Autres contributeurs
- Plateforme technologique de la production et structure des protéines, EPFL
- EPFL Laboratory for Biomolecular Modeling
- Institut suisse de bioinformatique
EPFL
Fonds national suisse de la recherche scientifique
NCCR Chemical Biology
Xu-Dong Kong, Jun Moriya, Vanessa Carle, Florence Pojer, Luciano A. Abriata, Kaycie Deyle, Christian Heinis. De novo development of proteolytically resistant therapeutic peptides for oral administration. Nature Biomedical Engineering 11 May 2020. DOI: 10.1038/s41551-020-0556-3