Des nanoparticules d'or pour déceler des fibrilles amyloïdes
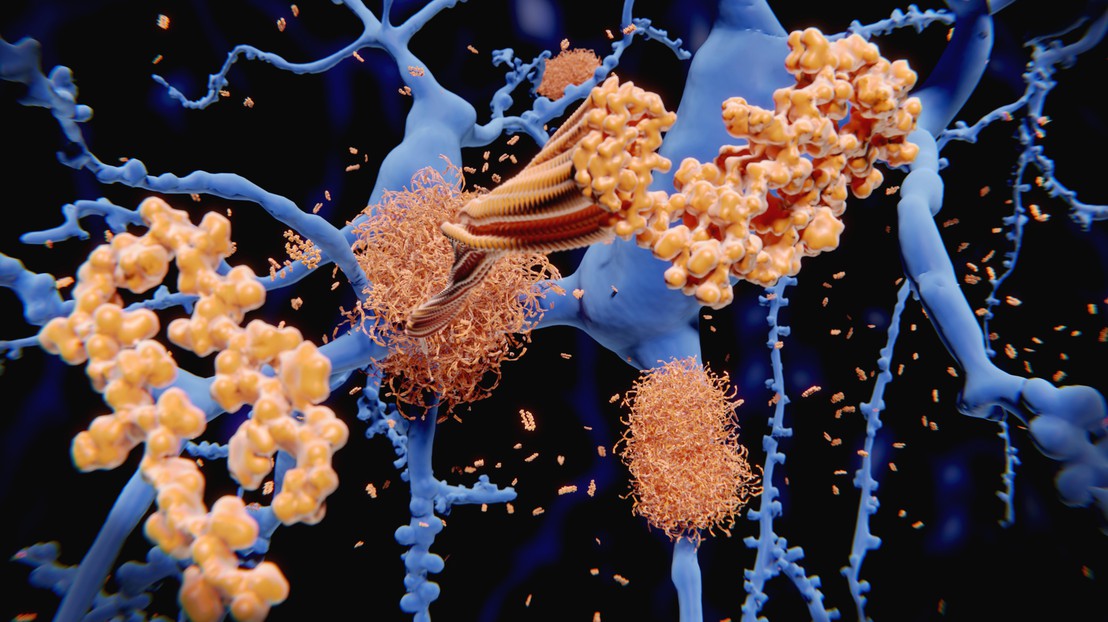
Le peptide bêta-amyloïde s'accumule dans les fibrilles amyloïdes qui forment des plaques amyloïdes denses. Crédit : selvanegra (photos iStock)
Des scientifiques de l’EPFL ont mis au point de puissants outils pour déceler la diversité des fibrilles amyloïdes, qui sont associées à la maladie d’Alzheimer ainsi qu’à d’autres affections neurodégénératives. Ils ont fait une percée en alliant des nanoparticules d’or et la microscopie électronique à transmission cryogénique pour obtenir des images rapides et sans précédent de fibrilles.
La maladie d’Alzheimer se caractérise notamment par la présence de structures semblables à des nœuds entre les cellules cérébrales. Ces structures appelées «fibrilles amyloïdes» sont formées par le fameux peptide bêta-amyloïde et la protéine tau, qui sont deux des cibles les plus étudiées pour mettre au point des traitements contre l’Alzheimer et d’autres maladies similaires.
Le peptide amyloïde bêta comme la protéine tau sont normalement produits dans le cerveau. Toutefois, ces protéines peuvent commencer à s’enchevêtrer pour former de grosses structures fibrillaires. Lorsque cela se produit, elles engendrent des troubles tels que la maladie d’Alzheimer et d’autres affections neurodégénératives.
Les structures fibrillaires se propagent dans le cerveau en passant d’une cellule à l’autre. On pense que cela provoque la dégénérescence de neurones, ce qui entraîne des dommages cérébraux et des déficiences cognitives telles que la perte de mémoire. Jusqu’à présent, les travaux de recherche étaient généralement axés sur le blocage de ce processus afin de ralentir la progression de la maladie.
Nous savons désormais que les fibrilles amyloïdes peuvent exister sous différentes formes et structures qui présentent diverses propriétés, ce qui pourrait expliquer pourquoi les patients souffrant des maladies d’Alzheimer et de Parkinson développent des symptômes cliniques différents. Il est donc important de saisir cette diversité et de la mettre en lien avec les symptômes de la maladie chez l’être humain ou avec l’activité biologique de ces espèces dans les modèles de maladies pour comprendre les mécanismes des maladies et mettre au point des thérapies et des diagnostics nouveaux.
Au vu de l’importance des fibrilles amyloïdes, beaucoup d’efforts ont été déployés pour les visualiser de manière aussi détaillée que possible afin d’avoir une meilleure compréhension de leur structure. En effet, déchiffrer les détails de leur structure pourrait permettre de détecter des points faibles qu’il serait possible de cibler avec des traitements, et d’ouvrir la voie pour créer des outils de diagnostic plus fiables. Malgré tout le travail qui a été accompli, toutefois, il s’est avéré très difficile de saisir la diversité des fibrilles dans des échantillons biologiques du fait de leur nature complexe et de leur hétérogénéité.
Utiliser de l’or (en nanoparticules)
Des scientifiques des équipes de Francesco Stellacci et d’Hilal Lashuel à l’EPFL ont trouvé une solution. Un article publié dans PNAS fait état de leur découverte capitale: les chercheurs y montrent que les nanoparticules d’or amphiphiles anioniques qui présentent un diamètre d’environ 3 nm possèdent une capacité unique d’indiquer de manière efficace le bord des fibrilles amyloïdes à l’état hydraté. Cela permet de visualiser plus facilement les différentes fibrilles amyloïdes.
Ce projet de recherche a été mené par la doctorante Urszula Cendrowska et le Dr Paulo J. Silva.
Ces travaux ont été possibles grâce à l’utilisation d’une forme particulière de TEM appelée «microscopie électronique à transmission cryogénique» (cryo-ME) pour produire une image des fibrilles garnies de nanoparticules. La principale caractéristique de la cryo-ME, c’est que l’échantillon (ici les fibrilles) est d’abord rapidement congelé à une température très basse. Il peut alors être visualisé dans son état «naturel» sans qu’il faille le préparer ou le colorer auparavant.
Grâce à la fois aux liaisons très efficaces des nanoparticules d’or et au potentiel de la cryo-ME, les scientifiques sont parvenus à obtenir des images de fibrilles et à déceler leur diversité avec une clarté sans précédent. Il s’agissait à la fois de fibrilles cultivées en laboratoire et de tissus réels de patients décédés.
«Nos conclusions révèlent une différence morphologique frappante entre les fibrilles produites dans des systèmes sans cellule et celles prélevées chez des patients, souligne Francesco Stellacci. Cela tend à confirmer l’hypothèse actuelle selon laquelle l’environnement physiologique joue un rôle majeur pour déterminer différents types de fibrilles amyloïdes.»
«Cette percée ouvre la voie pour élucider la base structurelle des souches et de la toxicité des amyloïdes, explique Hilal Lashuel. Les nanoparticules sont des outils puissants et absolument indispensables pour obtenir des images et une description du polymorphisme morphologique des amyloïdes dans différents types d’échantillons dans des conditions cryogéniques, en particulier pour des échantillons complexes issus d’agrégats pathologiques d’origine humaine.»
Le futur centre d’imagerie Dubochet sera consacré à la cryo-ME. Il sera créé par l’EPFL et l’Université de Lausanne (UNIL) pour exploiter pleinement cette technologie dans le domaine biomédical et pour la faire progresser en combinant l’expertise des deux écoles. Ce centre sera nommé en l’honneur de Jacques Dubochet, chercheur suisse qui a joué un rôle pionnier dans le développement de cette technologie dans les années 1980. Ses travaux lui ont valu le prix Nobel de chimie en 2017. Plus d’informations (en anglais): https://www.epfl.ch/about/philanthropy/the-dubochet-center-for-imaging/
Secrétariat d’Etat à la formation, à la recherche et à l’innovation (SEFRI), CHDI, Fondation allemande pour la recherche
Urszula Cendrowska, Paulo Jacob Silva, Nadine Ait-Bouziad, Marie Müller, Zekiye Pelin Guven, Sophie Vieweg, Anass Chiki, Lynn Radamaker, Senthil T. Kumar, Marcus Fändrich, Francesco Tavanti, Maria Cristina Menziani, Alfredo Alexander-Katz, Francesco Stellacci, Hilal A. Lashuel. Unraveling the complexity of amyloid polymorphism using gold nanoparticles and cryo-EM. PNAS 11 March 2020. DOI:10.1073/pnas.1916176117