Découvrir la biologie d'une maladie pédiatrique défigurante
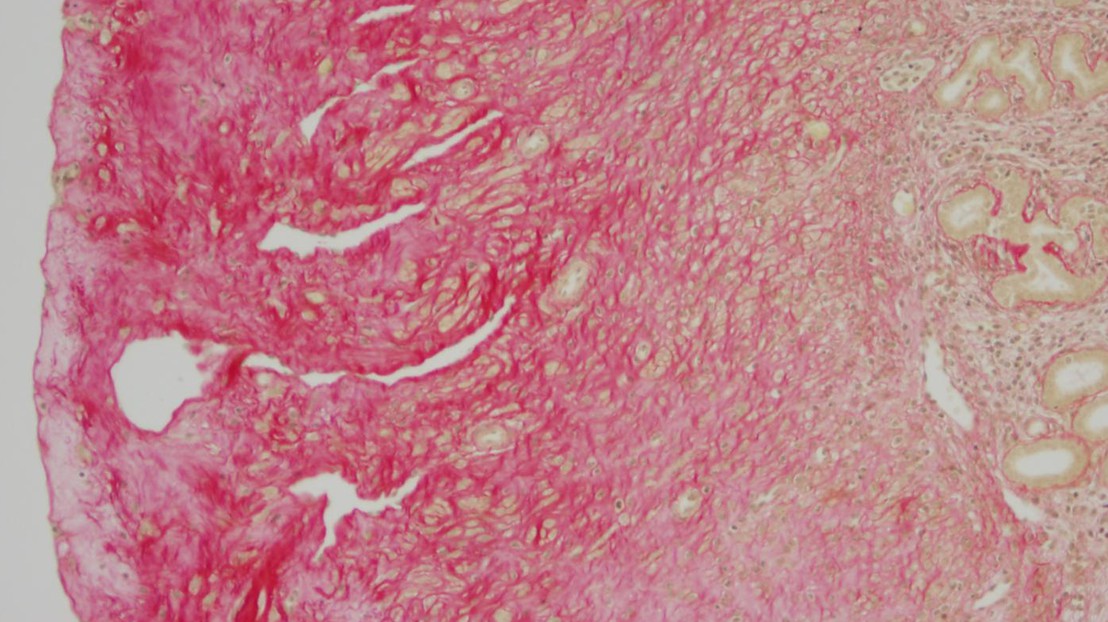
Accumulation de matériel extracellulaire dans un utérus de souris. © EPFL
Des scientifiques de l'EPFL ont identifié le mécanisme biologique derrière le Syndrome de la fibromatose hyaline, maladie défigurante, douloureuse et potentiellement mortelle.
Le Syndrome de la fibromatose hyaline (HFS) est une maladie génétique rare mais grave, qui affecte les bébés, les enfants et les adultes. Une substance vitreuse nommé hyaline s'accumule dans la peau et divers organes du patient, provoquant des déformations douloureuses et pouvant conduire à une mort prématurée. La maladie est provoquée par des mutations génétiques qui détruisent la fonction d'une protéine dont la fonction physiologique est mal connue. Des scientifiques de l'EPFL viennent d'étudier et de caractériser sa fonction pour la première fois, montrant qu'elle se lie et contrôle les niveaux corporels d'un important type de collagène. Ce travail est publié dans Nature Communications.
HFS est provoquée par une mutation d'un gène nommé CMG2, abrégé aussi ANTXR2 du fait qu'il rend les cellules sensibles aux infections d'anthrax. Le gène produit une protéine incorporée dans la membrane des cellules, et qui est connue pour se lier avec les toxines de l'anthrax, puis les introduire dans la cellule où elles développent leur action. Néanmoins, cela n'est pas la fonction physiologique de la protéine.
La mutation HFS du gène a pour effet de faire perdre sa fonction à la protéine. Une caractéristique de la maladie est l'accumulation de collagène dans de gros nodules sous la peau. Le collagène est la protéine la plus abondante chez les mammifères; on la trouve dans la peau, le cartilage, les vaisseaux sanguins, et même les dents. Il existe de nombreux types différents de collagène, qui entoure les cellules et soutient les divers tissus et organes du corps, en formant des réseaux structurels élastiques ou rigides.
Le laboratoire de Gisou Van der Goot à l'EPFL vient de montrer pour la première fois que la protéine CMG2 interagit avec un type de collagène appelé collagène VI. Normalement, CMG2 lie le collagène VI et, lorsqu'il y en a trop, l'intègre dans les lysosomes de la cellule où il sera dégradé. L'étude suggère que, dans HFS, la mutation du gène CMG2 stoppe la fonction de la protéine, ce qui conduit à l'accumulation de collagène VI en différentes parties du corps.
Le collagène VI est un type de collagène que de récentes études ont trouvé dans de multiples endroits du corps, comme le coeur, les neurones, les cellules immunitaires, les tendons, les poumons, et la peau. Selon le type de tissu, il joue différents rôles protecteurs et mécaniques, mais on a montré aussi qu'il était impliqué dans nombre de maladies, y compris dans la croissance des tumeurs cancéreuses.
Les chercheurs de l'EPFL ont étudié des nodules de HFS dans des modèles de souris aussi bien que chez un patient humain. Les souris femelles HFS souffrent de manière caractéristique d'accumulation de collagène dans l'utérus, ce qui les rend stériles. Le patient humain présente des nodules en différents endroits du corps, notamment dans le cuir chevelu et derrière les oreilles. En étudiant des prélèvements de tissus, les chercheurs ont constaté que chez les souris comme chez l'humain, les nodules étaient riches en collagène VI.
Désireuse de comprendre la relation entre CMG2 et le collagène VI, l'équipe a développé des souris double-knockout chez qui les gènes pour les deux protéines – CMG2 et collagène VI – ont été effacés. Des études antérieures ont montré que des souris knockout à CMG2 sont infertiles en raison de nodules intra-utérins qui les rendent infertiles. Mais, fait remarquable, les scientifiques ont découvert que lorsque le gène pour le collagène VI était effacé aussi, la souris retrouvait sa fertilité, ce qui confirme que CMG2 et le collagène VI sont liés d'une manière ou d'une autre dans HFS.
Des études consécutives ont montré que CMG2 se lie physiquement au collagène VI via un domaine spécialisé. La protéine CMG2 agit alors comme un récepteur, envoyant un signal à la cellule, et faisant que le collagène VI est intégré et dégradé dans les lysosomes de la cellule.
L'étude révèle une fonction physiologique majeure pour CMG2 et démontre son interaction avec le collagène VI. Cette interaction explique comment des symptômes de HFS majeurs surgissent lorsque la mutation du CMG2 brise la capacité de la protéine CMG2 à contrôler les niveaux de collagène VI, qui se sur-accumule et produit les symptômes douloureux et défigurants de la maladie.
Cette étude a été dirigée par le Global Health Institute de l'EPFL en collaboration avec l'Université de Berne, la Medical University d'Innsbruck, l'Université de Fribourg, le Centre hospitalier universitaire vaudois (CHUV) et l'Université de Padoue. Elle a été financée par le Fonds National Suisse (FNSF), la Fondation Gelu, la Fondation Francis et Marie-France Minkoff, la Fondation Solis, et l'Associazione ISI.
Référence
Jérôme Bürgi, Béatrice Kunz, Laurence Abrami, Julie Deuquet, Alessandra Piersigilli, Sabine Scholl-Bürgi, Ekkehart Lausch, Sheila Unger, Andrea Superti-Furga, Paolo Bonaldo, F. Gisou van der Goot. CMG2/ANTXR2 regulates extracellular for collagen VI which accumulates in Hyaline Fibromatosis Syndrome.Nature Communications XX XXX 2017. DOI: XXXXXXXXXXXXX