De la microscopie à super-résolution dans l'espace et dans le temps
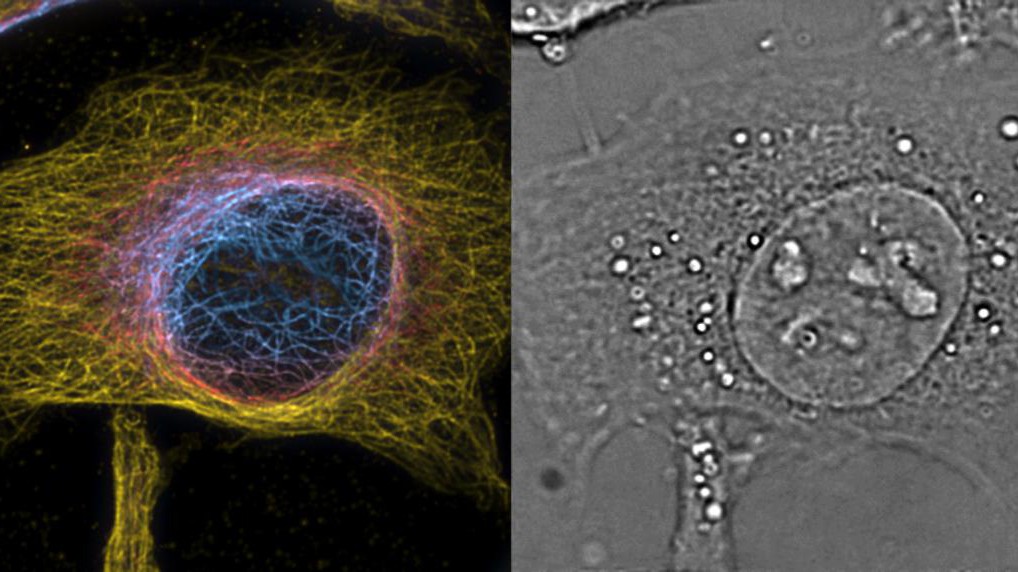
Une cellule visualisée avec la méthode PRISM © T. Lasser / EPFL
C’est une percée majeure pour l’imagerie biologique: des scientifiques de l’EPFL ont développé la première plate-forme de microscopie capable de réaliser de l’imagerie spatiale et temporelle à super-résolution, en réalisant des images jamais vues à l’intérieur de cellules vivantes. L’article fondateur est publié dans Nature Photonics.
La microscopie à super-résolution est une technique qui permet de «voir» au-delà de la diffraction de la lumière, et qui produit des images inédites à ce jour de cellules, de leurs structures intérieures et de leurs organelles. Cette technique a suscité un intérêt croissant, particulièrement depuis que ceux qui l’ont développée ont obtenu le Prix Nobel de chimie en 2014.
Toutefois, la microscopie à super-résolution présente un gros inconvénient: elle n’offre qu’une résolution spatiale. Cela peut suffire pour des échantillons statiques, comme des matériaux solides ou des cellules immobiles, mais dès lors qu’on touche à la biologie, les choses se compliquent. Les cellules vivantes sont très dynamiques et dépendent d’un ensemble complexe de processus biologiques, qui se produisent sur des échelles de temps inférieures à la seconde, et changent sans cesse. Dès lors, si l’on veut visualiser et comprendre comment les cellules vivantes – saines ou malades – fonctionnent, une résolution dans le temps (ou «temporelle») élevée est nécessaire.
Une équipe conduite par Theo Lasser, chef du Laboratoire d’Optique Biomédicale (LOB) de l’EPFL, vient de faire un grand pas vers la résolution de ce problème en développant une technique capable de réaliser à la fois de la microscopie à super-résolution en 3D, et de l’imagerie rapide de phase en 3D, avec un seul instrument. L’imagerie de phase est une technique qui traduit les changements de phase de la lumière provoquées par les cellules et leurs organelles en cartes d’indices de réfraction des cellules elles-mêmes.
Cette plate-forme unique, qualifiée de «microscope 4D», combine la sensibilité et la résolution temporelle élevée de l’imagerie de phase, et la spécificité et la résolution spatiale élevée de la microscopie à fluorescence. Les chercheurs ont développé un algorithme novateur capable de récupérer l’information de phase dans une pile d’images à champ brillant prises par un microscope classique.
«Avec cet algorithme, nous proposons un nouveau moyen de réaliser de la microscopie de phase quantitative en recourant à un microscope à fond clair, dit Adrien Descloux, l’un des auteurs principaux de l’article. Cela permet la visualisation directe et l’analyse des structures subcellulaires dans une cellule vivante, sans marquage.»
Pour parvenir à une imagerie 3D rapide, les scientifiques ont élaboré un prisme séparateur d’images qui permet l’enregistrement simultané d’une pile de 8 images déplacées en z. Cela signifie que le microscope peut réaliser de l’imagerie de phase 3D à haute vitesse dans un volume de 2.5μm x 50μm x 50μm. La vitesse du microscope est limitée par la vitesse de la caméra; pour cette démonstration, l’équipe a réussi à photographier des dynamiques intracellulaires jusqu’à 200 Hz. «Avec notre prisme en accessoire, vous pouvez convertir un microscope classique en un appareil d’imagerie ultra-rapide en 3D», dit Kristin Grussmayer, l’une des auteurs principaux de l’article.
Le prisme convient également pour l’imagerie en fluorescence 3D, que les scientifiques ont testé en utilisant l’imagerie super-résolue à fluctuation optique (SOFI). Cette méthode exploite le clignotement de colorants fluorescents pour améliorer la résolution 3D par l’analyse de corrélation du signal. Avec cet équipement, les chercheurs ont réalisé des images super-résolues en 3D de structures marquées dans les cellules, et les ont combinées avec de l’imagerie de phase 3D sans marquage. Les deux techniques se sont très bien combinées entre elles, et ont révélé des images fascinantes de l’architecture intérieure, du cytosquelette, et des organelles de cellules vivantes, à différents moments.
«Nous sommes enthousiasmés par ces résultats et les possibilités qu’offre cette technique», dit Hilal Lashuel, dont le laboratoire à l’EPFL s’est associé à celui de Théo Lasser, en utilisant la nouvelle technique pour étudier le mécanisme par lequel l’agrégation de protéines contribue au développement et à la progression des maladies neurodégénératives, comme celles de Parkinson et d’Alzheimer. «Cette technique fait progresser la visualisation active à haute-résolution de la formation d’agrégats d’alpha-synucléine pathologiques dans les neurones hippocampiques.»
L’équipe à nommé la nouvelle plateforme de microscopie PRISM, pour Phase Retrieval Instrument with Super-Resolution Microscopy. «Nous offrons PRISM comme un nouvel outil de microscopie, et prévoyons qu’il sera rapidement mis en œuvre par la communauté des sciences de la vie pour étendre le champ d’application de l’imagerie 3D à haute vitesse pour les investigations biologiques», dit Theo Lasser. «Nous espérons qu’il fera partie de l’équipement de pointe usuel pour la neuroscience et la biologie.»
Union européenne (Horizon 2020, Marie Skłodowska-Curie Grant Agreement and AD-gut European consortium)
Fonds National Suisse
A. Descloux, K. S. Grußmayer, E. Bostan, T. Lukes, A. Bouwens, A. Sharipov, S. Geissbuehler, A-L. Mahul-Mellier, H. A. Lashuel, M. Leutenegger, T. Lasser. Combined Multi-Plane Phase Retrieval and Super-Resolution Optical Fluctuation Imaging for 4D Cell Microscopy. Nature Photonics 12, 165–172 (26 February 2018). DOI: 10.1038/s41566-018-0109-4