De l'oxyde de fer pour soigner les tumeurs
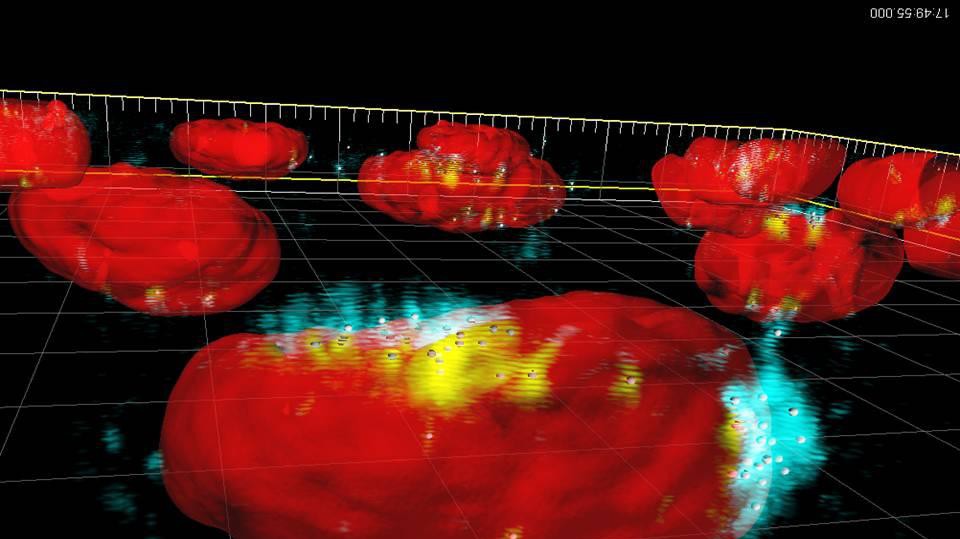
© Bio Imaging facility of EPFL
Détecter les cellules malades, les anéantir par la chaleur, ou leur injecter des médicaments de manière extrêmement précise. Autant de défis que les chercheurs de l’EPFL tentent de relever à l’aide de nanoparticules d’oxyde fer, développées au Laboratoire de Technologie des Poudres.
Image: Particules d’oxyde de fer superparamagnétiques (en bleu et jaune), absorbées par le noyeau d'une cellule (en rouge)
D’une taille de 5 à 10 nanomètres – ou millionièmes de millimètres- les particules d’oxyde de fer superparamagnétique (SPIONs) qu’étudie actuellement l’équipe du professeur Heinrich Hofmann, directeur du Laboratoire de Technologie des Poudres (LTP), ont cela d’intéressant qu’il est possible de les rendre magnétiques momentanément, en les soumettant à un champ extérieur. Une particularité non négligeable pour certaines applications dans le domaine médical, que ce soit pour le diagnostic de certaines maladies telles que l’Arthrite ou les tumeurs, ainsi que pour traiter les cellules cancéreuses.
Détection du cancer
Trois aspects principaux sont pris en compte par les chercheurs de l’EPFL: le diagnostic, le traitement et l’élimination des cellules malades. «Dans la pratique, les nanoparticules d’oxyde de fer sont déjà utilisées comme agent de contraste pour faire des imageries par résonance magnétique (IRM) en cas de tumeur du foie, indique le professeur Heinrich Hofmann. Nous cherchons maintenant à appliquer cette méthode à toutes sortes de tumeurs, ainsi qu’à des maladies telles que l’Arthrite. C’est d’aille urs le but d’un projet de la commission européenne FP-7 (NanoDiarA).»
urs le but d’un projet de la commission européenne FP-7 (NanoDiarA).»
Ci-contre: Lorsqu’on approche un aimant d’un récipient contenant des particules
d’oxyde de fer, le fluide vient se coller à la paroi.
Le principe est le suivant: les cellules cancéreuses sont dotées de récepteurs situés sur leur membrane externe, qui constituent en quelque sorte leur carte d’identité. Le revêtement des nanoparticules est alors adapté – ajout d’anticorps, par exemple – pour que ces dernières, une fois injectées par intraveineuse, aillent se fixer uniquement aux récepteurs de la cellule malade. Et comme une particule d’oxyde de fer change le contraste des tissus lorsqu’elle est soumise à un champ magnétique, il est ensuite possible de localiser très clairement par IRM la position exacte des cellules cancéreuses. «Pour l’instant, cette technique n’a été validée que pour la tumeur du foie, car pour chaque maladie, il faut ajouter d’autres éléments en surface qui changent le comportement des particules. Or il est difficile de comprendre le comportement des nanoparticules dans un fluide complexe tel que le sang», indique le professeur.
Traitement ciblé
Une partie de la recherche se concentre également sur une grande nouveauté: le largage ciblé de médicaments dans une cellule malade. «Il est possible de faire pénétrer les nanoparticules d’oxyde de fer à l’intérieur des organites, ou structures contenues dans le cytoplasme d’une cellule. Cette propriété permet d’introduire un médicament au sein même de la cellule», explique Heinrich Hofmann. Un avantage certain par rapport aux méthodes existantes, comme l’atteste Jean-Paul Vallée, professeur au département de radiologie de l’Université de Genève. «Actuellement, lors de l’absorption d’un traitement par voie systémique, la distribution du médicament se fait de manière peu sélective. Grâce à cette nouvelle méthode, nous pourrions éviter certains effets secondaires et traiter seulement les cellules qui en ont besoin.»
d’un traitement par voie systémique, la distribution du médicament se fait de manière peu sélective. Grâce à cette nouvelle méthode, nous pourrions éviter certains effets secondaires et traiter seulement les cellules qui en ont besoin.»
Destruction des tumeurs par la chaleur
Non contentes de détecter les cellules malades et de les soigner, les nanoparticules d’oxyde de fer ont enfin la capacité de détruire les tumeurs osseuses par hyperthermie. En cas de cancer des os, il arrive en effet souvent que la colonne vertébrale soit atteinte par des métastases. L’un des traitements actuels consiste à injecter dans le corps vertébral une sorte de ciment composé de polymères qui se solidifie, une fois dans l’organisme, et permet de ce fait de stabiliser les vertèbres. Selon les chercheurs de l’EPFL, en ajoutant à ce ciment des particules superparamagnétiques, avant de l’injecter, il serait possible d'effectuer un transfert d’énergie en appliquant un champ magnétique alternatif externe aux nanoparticules prisonnières dans l’implant, et de dégager ainsi une chaleur de 46°C. Ce procédé permettrait ainsi de détruire uniquement les cellules cancéreuses, qui supportent moins la chaleur que les tissus sains. «Cette méthode serait moins agressive que les lasers, qui brûlent même les cellules saines et qui laissent des déchets», ajoute le professeur.
Pour l’heure, ces trois applications se trouvent en test préclinique, et s’inscrivent dans plusieurs projets impliquant de nombreux partenaires, tels que le CHUV, l’Université de Genève et le CSEM, ainsi que des sociétés comme ANTIA ou Merck-Serono.