Comment une protéine instable peut entraîner la neurodégénérescence
Le modèle cellulaire montre l'ensemencement amyloïde par les fibrilles uniquement lorsque le noyau est exposé.2023 EPFL / Galina Limorenko - CC-BY-SA 4.0
Des scientifiques de l’EPFL ont reproduit les propriétés des agrégats anormaux de protéines détectés dans le cerveau de personnes atteintes de certaines maladies neurologiques comme la maladie de Charcot. Cette avancée permet de mieux comprendre le mécanisme sous-jacent et ouvre la voie à de nouvelles thérapies.
Plusieurs maladies neurodégénératives, telles que la maladie d’Alzheimer, la maladie de Parkinson et la maladie de Charcot, également appelée sclérose latérale amyotrophique (SLA) ou maladie de Lou Gehrig, sont dues à des protéines qui s’égarent avant de s’agréger en fibrilles s’accumulant dans des aires cérébrales spécifiques. Des scientifiques de l’EPFL ont découvert un nouveau mécanisme qui explique comment les agrégats deviennent pathologiques et s’étendent à différentes aires cérébrales. La protéine très instable appelée TDP-43 est suspectée d’être la principale responsable. Les scientifiques ont découvert que les agrégats de TDP-43 qui se forment dans le cerveau ne sont pas implicitement pathogènes jusqu’à ce qu’ils soient traités pour révéler leur noyau «collant». Les résultats sont publiés dans la revue Nature Neuroscience.
L’agrégation de la protéine TDP-43 est une caractéristique principale de la SLA et d’autres maladies neurodégénératives. Une fois formés, les agrégats de TDP-43 peuvent se propager dans différentes aires cérébrales où ils altèrent la TDP-43 normale et fonctionnelle. Mais qu’est-ce qui déclenche l’agrégation de la TDP-43? Quels sont les mécanismes responsables de la libération de ses effets pathogènes? Ce manque de connaissances empêche le développement de médicaments efficaces pour bloquer l’agrégation de la TDP-43 ou neutraliser ses propriétés toxiques.
Libérer les effets pathogènes de la TDP-43 par clivage
Dans cette récente étude de l’EPFL menée en collaboration avec des scientifiques de l’université de Pennsylvanie, Senthil T.Kumar et Hilal Lashuel ont découvert un nouveau mécanisme responsable de la libération des effets pathogènes de l’agrégat de TDP-43, préparé en éprouvette ou isolé à partir du cerveau de patientes et patients post-mortem. Les surfaces de ces agrégats de TDP-43 doivent d’abord être clivées par des enzymes pour révéler des surfaces collantes cachées qui attirent les protéines TDP-43 normales et provoquent la formation de nouveaux agrégats.
«Cette découverte a été facilitée par notre capacité à développer une nouvelle méthode de production de fibrilles, en laboratoire, qui partagent des caractéristiques morphologiques et structurelles avec celles trouvées dans le cerveau de patientes et patients atteints de SLA», déclare Senthil T. Kumar, principal auteur de l’article.
À l’aide de la cryomicroscopie électronique, où les échantillons sont cryogénisés avant d’être observés au microscope électronique, les chercheuses et chercheurs ont montré que les filaments de TDP-43 sont enfouis à l’intérieur d’un filament plus grand et sont inaccessibles, c’est-à-dire qu’ils ne sont pas encore pathologiques, car ils sont recouverts par les parties globulaires de la protéine. Tant que ces filaments sont enfouis, ils sont invisibles et ne sont pas accessibles à d’autres molécules ou protéines. Autrement dit, la TDP-43 devient pathologique lorsque son revêtement extérieur est clivé pour révéler ses filaments internes «collants», mais reste invisible lorsque son revêtement extérieur est intact.
«Nos résultats montrent que l’inhibition des enzymes responsables du clivage du filament de TDP-43 représente une stratégie thérapeutique viable pour ralentir la formation des agrégats de TDP-43 et empêcher leur propagation dans le cerveau, freinant ainsi la progression de la maladie. Dans un second temps, nous prévoyons d’identifier ces enzymes et de déterminer si l’inhibition de leur activité pourrait prévenir l’agrégation de la TDP-43 et la neurodégénérescence dans des modèles cellulaires et animaux de la SLA», explique Hilal Lashuel, professeur à l’EPFL et responsable du laboratoire qui a mené l’étude.
Ces récents résultats ont également des répercussions sur le développement de nouveaux outils et méthodes de diagnostic précoce de la SLA et d’autres maladies neurodégénératives. La couche globulaire protectrice peut expliquer pourquoi les fibrilles de TDP-43 sont si difficiles à détecter. Souvent, les méthodes standard et les colorants couramment utilisés pour détecter et surveiller la formation de fibrilles par d’autres protéines suspectes dans le cerveau n’ont pas permis de détecter les fibrilles de TDP-43. «Cela explique également pourquoi il a été très difficile de mettre au point des agents d’imagerie utilisant des fibrilles intactes de TDP-43. Ces agents d’imagerie sont indispensables pour permettre un diagnostic précoce, suivre la progression de la maladie et évaluer l’efficacité des nouvelles thérapies», poursuit Senthil T. Kumar.

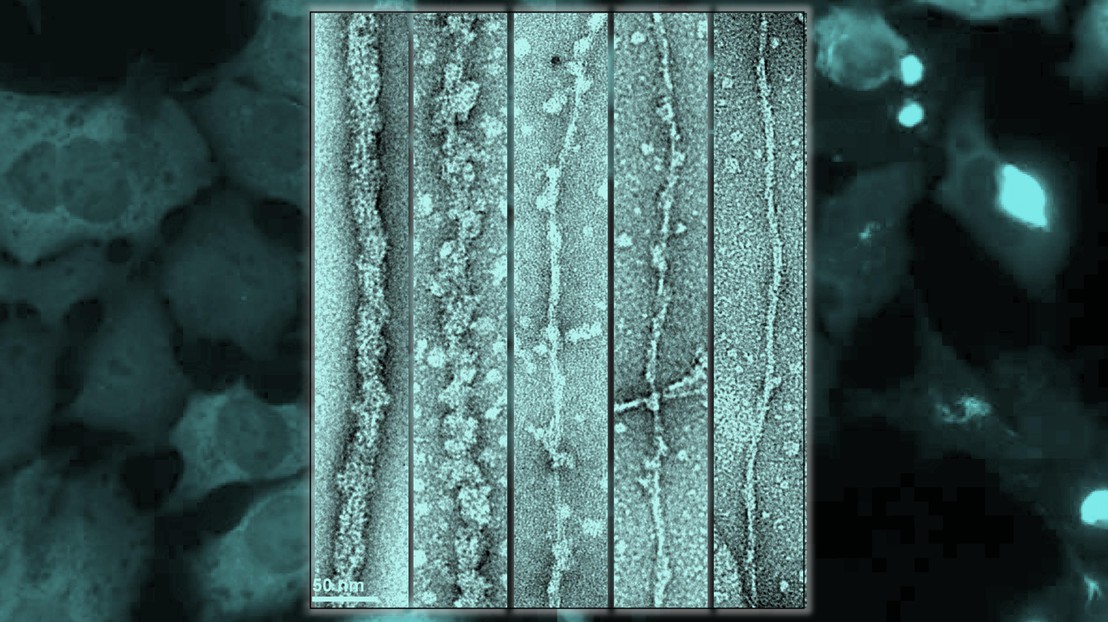
Au premier plan, les fibrilles de TDP-43 comprenant une protéine complète sont digérées par l'enzyme protéinase K (de gauche à droite), amincissant la fibrille en exposant le noyau amyloïde. En arrière-plan, le modèle cellulaire montre l'ensemencement par les fibrilles uniquement lorsque le noyau est exposé - à droite, les blobs brillants, alors que lorsque le noyau de fibrilles est masqué, à gauche, il n'y a pas d'ensemencement des agrégats dans les cellules , de sorte que nous ne pouvons voir que la coloration diffuse. Cela montre que le noyau amyloïde doit être démasqué pour rendre les fibrilles toxiques et capables d'ensemencement.
Importance de l’étude de la protéine complète
La TDP-43 est une protéine très instable qui s’agrège rapidement en différentes structures, ce qui complique la production reproductible d’agrégats de TDP-43 ressemblant à des pathologies. De nombreux scientifiques ont ainsi été contraints de travailler avec de petits fragments de la protéine, en particulier des fragments de la région responsable de son agrégation. «Quand nous avons déterminé la structure du fragment de protéine qui forme le noyau des fibrilles de TDP-43 préparées en laboratoire, nous avons obtenu une structure différente de celle des fibrilles de TDP-43 isolées du cerveau des patientes et patients, bien que la séquence d’acides aminés de ces fragments soit pratiquement identique», indique Senthil T. Kumar.
«Nos résultats montrent que les séquences protéiques entourant cette région sujette à l’agrégation jouent un rôle important dans la détermination de la structure finale et que la reproduction des propriétés des agrégats de TDP-43 dans le cerveau nécessite de travailler avec la protéine complète», affirme Hilal Lashuel. «C’est essentiel pour que les médicaments, les anticorps et les agents d’imagerie que nous développons en laboratoire aient plus de chances d’atteindre les agrégats de TDP-43 pertinents pour la maladie dans le cerveau des patientes et patients.»
Les chercheuses et chercheurs ont montré qu’ils pouvaient produire des fibrilles de TDP-43 avec la même séquence centrale que celle des fibrilles provenant du cerveau des patientes et patients. «Mais nous devons encore déterminer si le noyau de fibrille non masqué présente la même structure», précise Hilal Lashuel. «Si nous y parvenons, nous disposerons alors du seul système permettant de produire la pathologie réelle dans l’éprouvette. Cela aura d’importantes répercussions sur la compréhension de l’influence des mutations et modifications protéiques liées à la maladie sur l’agrégation de TDP-43, et facilitera le développement de nouveaux médicaments qui bloquent l’agrégation de TDP-43, neutralisent sa pathogénicité ou se lient aux agrégats de TDP-43 et facilitent leur détection dans le cerveau.