Une technique d'imagerie dévoile la vie des cellules en direct
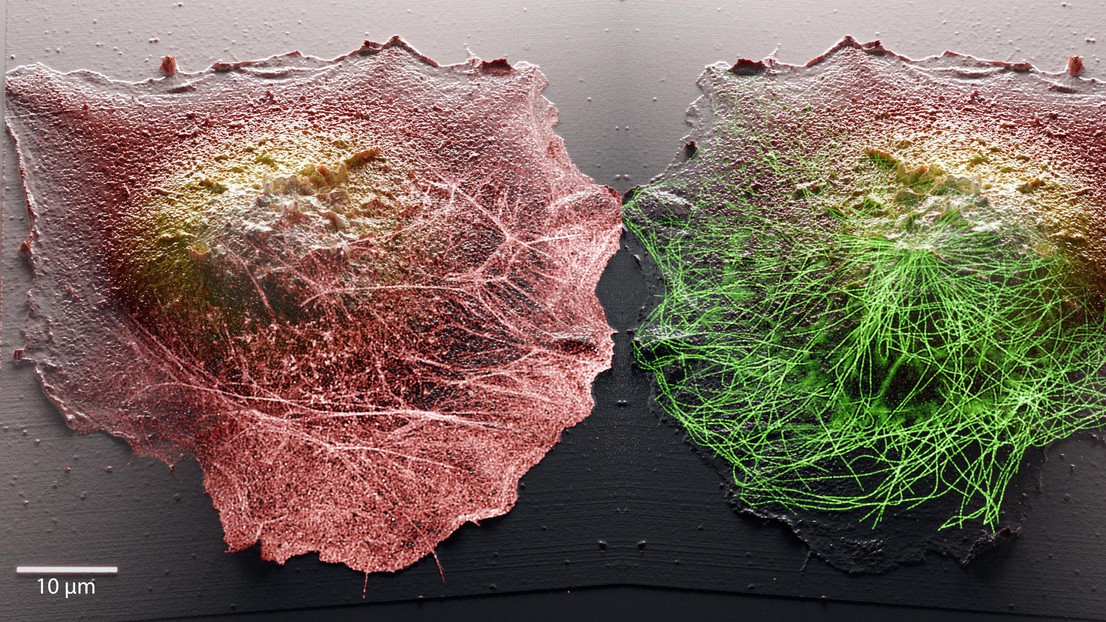
© LBNI-LBEN
En combinant deux méthodes différentes, des chercheurs ont réussi à observer ce qu’il se passe en même temps à l’intérieur d’une cellule et sur sa membrane, obtenant ainsi une vision inédite des processus cellulaires en cours, notamment, lors d’infections.
Élément de base du vivant, la cellule est le siège de phénomènes biologiques complexes. Pouvoir les étudier est crucial pour comprendre et traiter certains dysfonctionnements et maladies. Mais l’observation de la matière vivante à l’échelle micro et nanométrique est un vrai défi. Grâce à la combinaison de deux techniques différentes et à une collaboration entre deux laboratoires de l’EPFL, une nouvelle méthode permet désormais de voir des cellules en pleine action, avec une précision inédite. L’invention a fait l’objet de deux publications, l’une dans Nature Communications en juillet et l’autre aujourd’hui dans la revue ACS Nano.
«Aucune des méthodes d’imagerie existantes n'était jusque-là adaptée à l'observation fine des cellules, explique Georg Fantner, qui dirige le Laboratoire de bio- et nano-instrumentation de l’EPFL (LBNI). La microscopie électronique implique de mettre les échantillons sous vide puis de les bombarder d'électrons. Rien ne survivant à un tel traitement, la matière est donc morte avant même que nous y jetions un œil. La microscopie optique permet d’observer sans détruire, mais la résolution n’est pas suffisamment bonne pour obtenir une image de la surface cellulaire en 3D. Et une dose de photons plus élevée pourrait provoquer des dommages».
Les chercheurs ont donc eu l’idée d’associer deux méthodes: une microscopie optique à super résolution permettant une observation ciblée de l'intérieur des cellules, et une technologie de microscopie à sonde, appelée scanning ion-conductance microscopy. Cette dernière utilise traditionnellement une aiguille pointue, qui palpe directement la surface de l’objet à observer afin d’en dessiner la topographie. Or, elle n’est pas indiquée dans le cas de cellules vivantes, la pointe les perturbant en les touchant physiquement. L’aiguille a donc été remplacée par une technique de balayage par laser, basée sur la détection des ions - un type d’atome portant une charge électrique - présents à la surface de la cellule.
Tout est dans l'interaction
Cette combinaison permet une observation inédite. Car la microscopie optique offre une vue à l'intérieur de la cellule, tandis que la microscopie à balayage donne une topographie en 3D de la membrane. Les scientifiques peuvent donc désormais voir l’intérieur et l’extérieur de la cellule en même temps, et ainsi faire des liens entre des phénomènes se déroulant synchroniquement sur ces deux plans. Ils pourront par exemple cibler certains éléments de la machinerie moléculaire interne lorsqu’ils repèrent que la membrane se déforme, perd des éléments ou absorbe des matériaux.

«La membrane est le lieu des interactions entre la cellule et le monde extérieur, décrit Samuel Leitao, doctorant au Laboratoire de bio- et nano-instrumentation LBNI. C’est là que s’expriment de nombreux processus biologiques et changements morphologiques, comme les infections cellulaires. Avec cette technique, nous pouvons cibler des molécules spécifiques et cartographier leur action au sein de la cellule pour mieux comprendre leur corrélation avec les événements membranaires».
Une meilleure qualité d’image
«Un autre avantage de cette combinaison de techniques est le gain obtenu en matière de qualité d’image. Nous pouvons désormais observer ces processus cellulaires avec bien plus de précision», se réjouit Vytautas Navikas, doctorant au Laboratoire de biologie à l'échelle nanométrique de l’EPFL (LBEN), qui s’est occupé de la partie optique du système.
Selon les chercheurs, cette nouvelle technique, qui est applicable pour observer des processus tels que la motilité cellulaire, la différenciation, ou encore la communication de cellule à cellule, ouvre la porte à un grand nombre de nouvelles études. Elle pourrait par exemple s’avérer très utile en biologie des infections, mais aussi en immunobiologie et en neurobiologie, des domaines où il est important de comprendre comment la cellule réagit en temps réel à un stimulus extérieur.
Cette étude est aussi un bel exemple d’une invention générée essentiellement par des contacts fortuits entre chercheurs et une collaboration fructueuse entre les expertises de deux laboratoires de l’EPFL.

"Time-Resolved Scanning Ion Conductance Microscopy for Three-Dimensional Tracking of Nanoscale Cell Surface Dynamics".
Publié le 9 novembre 2021 in ACS Nano, par Samuel M. Leitao, Barney Drake, Katarina Pinjusic, Xavier Pierrat, Vytautas Navikas, Adrian P. Nievergelt, Charlène Brillard, Denis Djekic, Aleksandra Radenovic, Alexandre Persat, Daniel B. Constam, Jens Anders et Georg E. Fantner.