Un analogue ultraviolet de la RMN bidimensionnelle
© 2013 EPFL
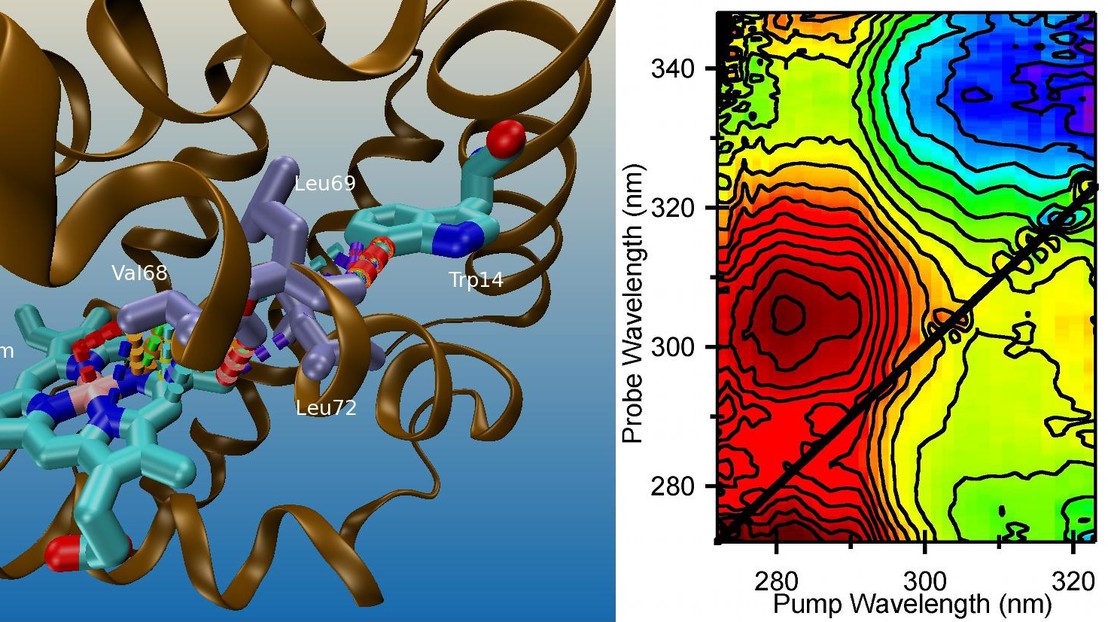
Détecter des transferts d’énergie et d’électrons impliquant les acides aminés
Au cours des vingt dernières années, des efforts ont été déployés afin de pousser les méthodes de spectroscopie RMN (résonance magnétique nucléaire) bidimensionnelle (2D) du domaine des radiofréquences, d’abord vers l’infrarouge (spectroscopie 2D vibrationnelle) puis, au milieu des années 2000, vers le visible (spectroscopie 2D électronique), avec l’avantage que les couplages entre dipôles (chromophores) vibrationnels ou électroniques sont plusieurs ordres de grandeur supérieurs à ceux de la RMN, tout en fournissant une résolution temporelle accrue, de l’ordre de la sub-picoseconde.
L’idée d’amener la spectroscopie 2D vers l’ultraviolet (UV) en dessous de 300 nm offre l’avantage supplémentaire d’accéder à la région spectrale d’absorption de lumière par les acides aminés et les acides nucléiques des systèmes biologiques. Toutefois, à cause des grandes largeurs spectrales de ces espèces (30-50 nm), la spectroscopie 2D dans l’UV est restée un défi technologique majeur.
Récemment, le groupe du Prof. Chergui a développé un montage expérimental à cette fin et, dans un récent article paru dans la revue Science, en a démontré les performances dans une étude sur les hémoprotéines. En effet, outre le fait qu’ils sont parvenus à démêler les contributions spectrales superposées de trois chromophores (l’hème et deux tryptophanes), les chercheurs du groupe du Prof. Chergui ont mis en évidence des processus de transfert d’électrons entre un des tryptophanes et l’hème, dont l’existence était inconnue à ce jour. En effet, il avait toujours été admis que la désexcitation des tryptophanes dans les hémoprotéines (et en général dans la plupart des systèmes biologiques) est due à un transfert d’énergie (dénommé FRET). Ces résultats soulèvent des questions quant à la supposition systématique de FRET pour expliquer le déclin de la fluorescence du tryptophane dans les systèmes biologiques et son utilisation comme « règle spectroscopique » (spectroscopic ruler) de la dynamique des proteines.
Dans une optique plus générale, la capacité de la spectroscopie 2D UV à mettre en évidence des couplages entre chromophores dans les systèmes biologiques permet d’envisager des applications comme l’étude des interactions entre une protéine et sa cible (médicament, ADN, etc.).
An Ultrabroad Femtosecond 2D Transient Absorption Set-Up in the Ultraviolet
G. Auböck, C. Consani, F. van Mourik and M. Chergui
Optics letters 37 (2012) 2337
Ultrafast tryptophan-to-haem electron transfer in myoglobins: a two-dimensional UV spectroscopy study
C. Consani, G. Auböck, F. van Mourik and M. Chergui
Science (DOI: 10.1126/science.1230758)