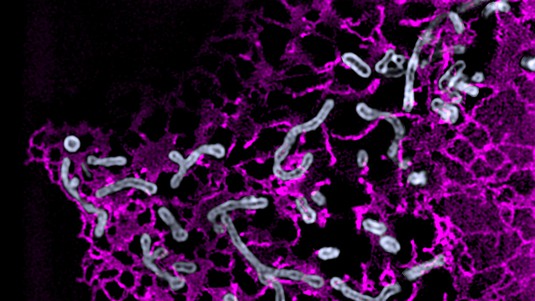
Le double tranchant des mitochondries

© 2021 EPFL
A l’aide d’un microscope sur-mesure à haute résolution, les scientifiques de l’EPFL ont découvert où et pourquoi les mitochondries se divisent, et mettent un terme aux controverses sur la machinerie moléculaire sous-jacente de la fission mitochondriale. Soit ces organelles se partagent en deux, soit elles se débarrassent de leurs extrémités pour s’autoréguler. Les résultats sont publiés dans Nature.
Soit les mitochondries se divisent en deux pour proliférer dans la cellule, soit elles s’amputent de leurs extrémités pour évacuer des éléments défectueux. C’est la conclusion des biophysiciennes de l’EPFL dans leurs derniers travaux consacrés à la fission mitochondriale. Une évolution majeure, par rapport à l’explication standard du cycle de vie de cette organelle bien connue, usine énergétique des cellules. Les résultats sont publiés aujourd’hui dans Nature.
« Jusqu’à cette étude, on comprenait mal comment la mitochondrie décidait où et quand se diviser », explique la biophysicienne de l’EPFL Suliana Manley, auteure principale de l’étude.

La grande question: réguler la fission mitochondriale
La fission est importante pour que les mitochondries prolifèrent, ce qui est fondamental pour la croissance cellulaire. Quand la cellule grandit et qu’elle finit par se diviser, elle a besoin de plus d’énergie, donc de plus de mitochondries. Mais ces dernières ont leur ADN propre, séparé de celui de la cellule. Elles suivent leur propre cycle de vie. Elles ne peuvent proliférer qu’en copiant leur ADN et en se divisant elles-mêmes.
L’explication standard de la fission mitochondriale décrit comment la machinerie des protéines divise la mitochondrie en deux soeurs, ce qui permet la prolifération. Mais dans la littérature scientifique, de plus en plus d’indices suggéraient que cette fission servait également à évacuer du matériel défectueux.
« Pour moi, la grande question c’était de comprendre comment les mitochondries savent quand il faut proliférer ou quand il faut dégrader. Comment la cellule régule ces deux fonctions opposées de la fission mitochondriale? », explique la postdoctorante Tatjana Kleele, première auteure de l’étude.
Quatre ans et 2000 mitochondries plus tard, Tatjana Kleele et Suliana Manley ont découvert que l’emplacement de la scission des mitochondries n’est pas le fait du hasard.
Nanomicroscopie à haute résolution
Jusqu’à aujourd’hui, la dynamique de la fission mitochondriale n’avait jamais été mesurée en large nombre et à très haute précision. Mais grâce à leur microscope à super-résolution (iSIM), les biophysiciennes de l’EPFL ont pu observer individuellement de nombreuses mitochondries, quand elles se divisent en plus petits segments, dans des cultures de cellules cancéreuses et de myocytes cardiaques de souris.
« Pour la microscopie optique, la taille d’une mitochondrie se trouve juste à la limite de la diffraction de la lumière. Cela rend impossible l’étude de la physiologique mitochondriale et des changements de conformation, à des niveaux plus bas que l’organelle. En utilisant un microscope à super-résolution construit sur-mesure, qui permet une imagerie rapide avec un doublement de la résolution, nous avons pu analyser de nombreuses divisions mitochondriales », explique Suliana Manley.
A partir de ces observations, les scientifiques ont pu quantifier l’emplacement de la fission avec une haute précision, mais aussi détecter des signes de dysfonctionnement dans de petites parties des organelles grâce à des biocapteurs fluorescents. Dans une mitochondrie, un pH bas est signe que la pompe à proton impliquée dans la production d’ATP, l’énergie de la cellule, ne fonctionne plus de manière optimale. Les concentrations de calcium fournissent des informations à propos des structures des mitochondries.
Les scientifiques ont observé deux types de division mitochondriale: au milieu et en périphérie. L’équipe a découvert que les divisions au milieu de la mitochondrie présentaient toute la machinerie moléculaire de fission décrite par l’explication standard. Par contre, la division périphérique était associée à des dysfonctionnements et à du stress; des deux mitochondries soeurs, la plus petite était dégradée.
Ensuite, les biophysiciennes ont voulu savoir si elles pouvaient observer le même comportement dans des cellules cardiaques de rongeurs. En collaboration avec le laboratoire de Thierry Pedrazzini (CHUV), elles ont découvert que ces myocytes de souris peuvent réguler indépendamment deux types de fissions, parce qu’elles exploitent des protéines et des mécanismes différents.
Les scientifiques ont découvert que lorsqu’on stimule les myocytes pour les faire fortement réagir avec des molécules pharmaceutiques, on observe une augmentation du taux de divisions périphériques. En d’autres termes, quand les myocytes cardiaques sont sur-stimulées ou stressées, les mitochondries produisent de considérables quantités d’énergie pour que ces cellules du coeur battent rapidement. Les radicaux libres, ou dérivés réactifs de l’oxygène, sont un résidu de cette production d’énergie. Ils sont connus pour entraîner des dysfonctionnements à l’intérieur des cellules et des défaillances des mitochondries. Les divisions périphériques deviennent donc plus fréquentes, pour éliminer ces mitochondries endommagées par le stress.
Quand les scientifiques ont stimulé les myocytes cardiaques afin qu’elles prolifèrent, ils ont effectivement observé plus de divisions dans la zone du milieu.
« Tel que nous l’avons observé au laboratoire, ce comportement de la fission mitochondriale est très probablement analogue dans toutes les cellules de mammifères », explique Tatjana Kleele.
Selon Suliana Manley, la régulation de la fission mitochondriale est importante pour la compréhension de certaines maladies humaines tels les pathologies neurodégénératives ou les problèmes cardiovasculaires. Les deux sont associés à un taux élevé de fissions. « Les stratégies thérapeutiques sont rares, parce qu’on provoque de nombreux effets secondaires si l’on cherche à agir sur la fission mitochondriale. En identifiant les protéines spécifiquement impliquées dans la biogenèse ou la dégradation, nous pouvons fournir des cibles plus précises aux approches pharmacologiques », conclut Suliana Manley.