La lumière des lucioles révolutionne les diagnostics médicaux

Rudolf Griss, Kai Johnsson et Alberto Schena dans leur laboratoire ©Alain Herzog/EPFL
Des scientifiques de l’EPFL ont mis à profit la lumière émise par les lucioles pour détecter des molécules biologiques sans recourir à des systèmes onéreux et complexes.
La biologie et la médecine ont souvent besoin de repérer des molécules biologiques. Dans les diagnostics de cancer par exemple, les médecins doivent savoir avec rapidité et fiabilité si des tumeurs sont présentes dans le corps d’un patient. Bien que de telles méthodes de détection existent, elles requièrent généralement beaucoup de temps, de travail et d’argent. Or, des chercheurs de l’EPFL viennent de modifier chimiquement l’enzyme responsable de la lumière des lucioles afin qu’elle puisse « flairer » certaines molécules biologiques et émettre un signal lumineux. En résulte un système de détection simple, précis et bon marché susceptible de bouleverser le domaine. Cette étude, sur laquelle est basée une startup de EPFL, est publiée dans Nature Communications.
Le laboratoire de Kai Johnsson de l’EPFL dirigé par Alberto Schena et Rudolf Griss a ajouté une petite étiquette à l’enzyme luciférase, qui produit la lumière des lucioles. Ladite « balise » est ensuite utilisée pour détecter une protéine cible. Une fois sa tâche accomplie, la luciférase émet un signal lumineux visible à l’œil nu.
Ce n’est pas la première fois que l’équipe démontre son savoir-faire en la matière. En 2014, elle avait déjà développé une molécule simple pour le suivi médicamenteux, qui a donné naissance à une startup, Lucentix. En réfléchissant de façon novatrice, elle est parvenue à contourner les affres du génie protéique: au lieu de muter la luciférase pour la rendre sensible à une protéine donnée – ce qui nécessiterait une masse de travail énorme – elle lui a tout simplement attaché une petite étiquette chimique.
Celle-ci fonctionne comme un interrupteur: elle bloque la luciférase, ce qui l’empêche de produire de la lumière. Lorsqu’elle détecte la protéine cible par contre, elle s’y lie et annule ce faisant le blocage de la luciférase. Cette dernière est donc libre d’allumer la lumière, ce qui transmet le signal que la cible a été localisée. En d’autres termes, les chercheurs ont mis au point une solution chimique à un problème biologique.
« La luciférase marquée peut laisser penser à une molécule cyborg, » explique Kai Johnsson. « A moitié biologique, à moitié synthétique. Comment pourrait-on rendre la luciférase sensible à la présence d’une autre protéine simplement par mutation? C’est une charge de travail herculéenne. Grâce à cette astuce chimique, nous devons juste nous préoccuper de générer une balise capable de détecter la protéine cible. »
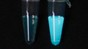
L’activation de la luciférase lorsqu’elle repère la protéine voulue est assez claire pour être perçue à l’œil nu. Résultat, nul besoin d’appareils de lecture chers et complexes.
Cette trouvaille aura des implications additionnelles. « Il s’agit en effet d’un design générique, » ajoute Kai Johnsson. « Celui-ci montre de quelle manière exploiter la chimie synthétique pour créer des biocapteurs sophistiqués à partir de protéines. »
Cette étude a été soutenue par le FNS et le Centre National de Compétence dans la Recherche (NCCR) en biologie chimique, Lausanne, Suisse.
Source
Schena A, Griss R, Johnsson K. Modulating protein activity using tethered ligands with mutually exclusive binding sites.Nature Communications 22 July 2015. DOI: 10.1038/ncomms8830