Images en miroir et molécules complexes
© 2013 EPFL
Des scientifiques de l’EPFL ont synthétisé des matrices de traitements contre le cancer et la démence en partant de matières premières simples et bon marché.
Les liaisons carbone-hydrogène (C–H) au cœur de la plupart des composés organiques présentent un intérêt particulier pour la recherche scientifique, car leur clivage (fonctionnalisation C–H) se révèle un outil puissant dans la création de molécules complexes à partir de matériaux de départ très répandus. Même si les chimistes ont longtemps pensé que les liaisons C-H n’étaient pas réactives, nombreuses sont les fonctionnalisations C-H désormais connues. Cependant, peu de ces réactions parviennent à faire la différence entre les énantiomères des molécules et à en choisir un plutôt que l’autre. Une récente publication de Angewandte Chemie décrit comment des scientifiques de l’EPFL ont mis au point une méthode permettant la production énantiosélective d’une classe de composés, les benzodiazépines, susceptible de donner un nouveau souffle aux traitements anti-Alzheimer.
En chimie, les énantiomères sont des molécules images l’une de l’autre dans un miroir, mais non superposables, comme nos mains par exemple. Appelé chiralité, ce phénomène est très commun dans la nature. Les énantiomères, dotés d’énergies équivalentes, sont logiquement produits en quantité égale lors d’une réaction. Cependant, bien qu’elles présentent une structure et des atomes similaires, ces molécules peuvent avoir des propriétés complètement dissemblables en raison de leur chiralité différente, ce qui peut poser problème lorsque seule l’une d’entre elles est requise.
De nombreux blocs de construction naturels, comme les sucres et les acides aminés, sont produits uniquement sous la forme d’énantiomère simple. De tels systèmes biologiques présentent donc un haut degré de chiralité chimique et vont souvent réagir différemment lorsqu’ils sont exposés aux énantiomères d’un composé. Le goût, l’odeur, l’efficacité ou l’innocuité des médicaments sont de bons exemples de cette énantiosélectivité, qui fait l’objet de nombreuses recherches vu l'importance significative des énantiomères. Pourtant, ces réactions spécifiques sont très difficiles à atteindre.
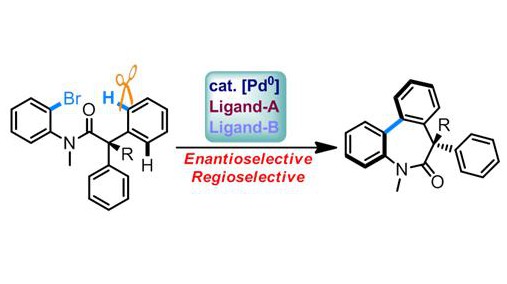
L’équipe de Nicolai Cramer à l’EPFL est parvenue à réaliser une fonctionnalisation C-H à haut degré d’énantiosélectivité par clivage de la liaison C-H. Ces chercheurs s’intéressent depuis longtemps aux fonctionnalisations C–H dans le but de créer des hétérocycles chiraux contenant du nitrogène, qui sont omniprésents dans les produits naturels et composés bioactifs. Forts de ce constat, ils se sont employés à concevoir une réaction susceptible de produire des benzodiazépines, une importante classe de composés utilisés dans des traitements potentiels contre le cancer et Alzheimer.
Une telle méthode a nécessité la cyclisation de deux groupes aryliques du substrat par clivage des liaisons C–H. Les chercheurs ont déclenché cette réaction au moyen de complexes de palladium, les transformations C-H catalysées par de tels métaux de transition ayant déjà fait leurs preuves dans le domaine. Cette stratégie repose sur les effets coopératifs existants entre un ligand de phosphine et un carboxylate volumineux lors de l’étape communément appelée métallation dépronotation concertée (CMD), qui s’est déjà montrée un outil efficace dans la fonctionnalisation des liaisons C-H.
Au final, les scientifiques sont parvenus à synthétiser des benzodiazépines hautement pertinents et fonctionnalisés en montrant une grande habileté à sélectionner les énantiomères « corrects ». Ils ont ainsi trouvé un moyen d’atteindre une sélectivité absolue des activations C–H concurrentielles, qui pourrait également produire des composés avec des cycles de cinq ou six chaînons et utilise en sus des matières premières bon marché et très répandues. Cette découverte va donc avoir des effets déterminants sur l’industrie de l’assemblage chimique rapide et modulaire des molécules complexes.