Des chercheurs démontent la machine de guerre des bactéries
© photos.com
Une nano-machine tueuse de cellules: les chercheurs de l’EPFL décryptent la stratégie d’attaque de certaines bactéries, dont le tristement célèbre staphylocoque doré.
C’est une véritable mécanique d’agression à l’échelle nanométrique. Certaines bactéries, dont le staphylocoque doré, ont la faculté de déployer de minuscules dards. Une arme biologique, qui tue la cellule hôte en transperçant sa membrane. Des chercheurs de l’EPFL ont démonté pièce par pièce cette intrigante petite machine: un assemblage de protéines qui, en se dépliant au bon moment, prend la forme d’un aiguillon. Publiée dans Nature Chemical Biology, cette découverte ouvre de nouvelles perspectives de lutte contre ces pathogènes, toujours plus résistants aux traitements antibiotiques.
Pour s’attaquer à la cellule hôte, la machine de guerre doit tout d’abord s’y fixer. A la surface de l’agresseur, un mécanisme composé de sept protéines, repliées et assemblées en anneau. Les chercheurs sont parvenus à montrer comment, le moment venu, ces longues molécules se plient de manière à former une sorte d’aiguillon.
Le déclencheur n’est autre qu’une pièce de la machine - un peptide, soit une petite molécule organique. Exposé aux enzymes de l’organisme hôte, il se détache. L’équilibre de l’assemblage est modifié: les protéines adoptent une nouvelle forme, se déploient dans un mouvement circulaire et forment un aiguillon, qui va percer la membrane de la cellule-hôte.
Une mécanique à l’échelle moléculaire
Aucune réaction chimique n’est impliquée dans cette arme biologique – il s’agit d’un phénomène mécanique, mais à l’échelle moléculaire. Matteo Dal Peraro, co-auteur, utilise d’ailleurs volontiers le terme de «nanomachine» pour désigner cet outil d’agression.
Les chercheurs de l’EPFL ont travaillé sur des souches d’Aeromonas hydrophila – une bactérie bien connue des voyageurs pour les troubles intestinaux qu’elle provoque. Dans une boîte à pétri, ils pouvaient à l’envi provoquer la formation des dards, en exposant les microorganismes à des enzymes digestifs. Ils sont parvenus à modéliser très précisément comment les protéines se plient et se réarrangent pour former l’aiguillon, une fois le peptide absent.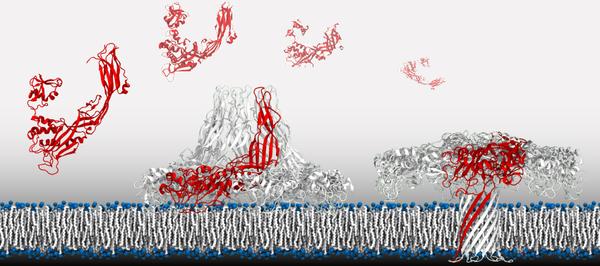
L'assemblage de protéines - à droite, il forme un aiguillon qui perce la membrane cellulaire
Entraver le mécanisme d’agression
Pour Gisou Van der Goot, co-auteur, cette découverte ouvre de nouvelles perspectives thérapeutiques, par exemple dans les cas d’infection nosocomiale aux staphylocoques. «Nous pourrions imaginer des cathéters recouverts de peptides de substitution, explique-t-elle. Ils pourraient empêcher la formation de l’anneau et donc de l’aiguillon. Nous éviterions ainsi de nombreuses infections en milieu hospitalier.»
S’attaquer aux armes de la bactérie, plutôt qu’à la bactérie elle-même. Le concept est séduisant, à l’heure où les résistances multiples aux antibiotiques sont toujours plus fréquentes. «Ce mode d’action aurait l’avantage de ne pas provoquer de mutations, donc de résistance, chez les bactéries pathogènes», conclut la chercheuse.
---
Matteo T Degiacomi,Ioan Iacovache, Lucile Pernot, Mohamed Chami, Misha Kudryashev, Henning Stahlberg, F Gisou van der Goot & Matteo Dal Peraro, Molecular assembly of the aerolysin pore reveals a swirling membrane-insertion mechanism, in Nature Chemical Biology (2013) doi:10.1038/nchembio.1312