Des «agents doubles» au cœur des tumeurs
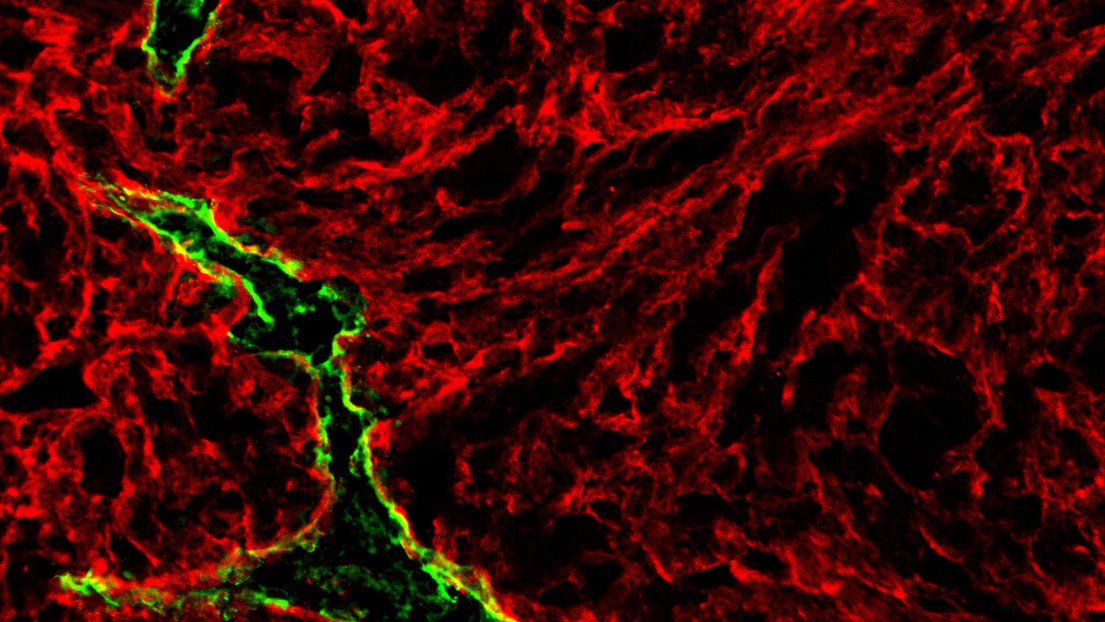
Un vaisseau lymphatique intratumoral (en vert) photographié dans le micro-environnement (en rouge) d'une tumeur primaire de mélanome stimulée par BRAF. (Crédit: Manuel Fankhauser et Maria Broggi/EPFL)
Des scientifiques de Suisse et des Etats-Unis ont montré que les vaisseaux lymphatiques peuvent aussi bien favoriser les métastases que l'infiltration des lymphocytes T dans celles-ci, ce qui ouvre de nouvelles perspectives pour l'immunothérapie du cancer.
De nombreux cancers, tels que les mélanomes, sont connus pour former des métastases et se répandre par les vaisseaux lymphatiques proches. Ce processus, la lymphangiogenèse, aide également la tumeur à échapper au système immunitaire du patient; on pourrait donc s'attendre à ce qu'en inhibant la lymphangiogenèse, on pourrait accroître l'efficacité des immunothérapies anti-cancéreuses, qui ne sont efficaces que chez une minorité de patients. Mais par une surprenante découverte, des scientifiques de l'EPFL et des Etats-Unis ont trouvé que c'était le contraire: la lymphangiogenèse accroît en réalité l'efficacité de l'immunothérapie contre les mélanomes. Publiée dans Science Translational Medicine, l'étude comporte des implications significatives pour de nouvelles thérapies anti-cancéreuses.
L'immunothérapie anti-cancéreuse est l'un des traitements les plus prometteurs contre les tumeurs. Le processus implique d'empêcher la tumeur d'annihiler les attaques du système immunitaire, en permettant ainsi au système immunitaire du patient de la détruire. Mais en dépit de résultats très encourageants sur le plan clinique, seule une petite partie des patients parvient à répondre à l'immunothérapie. Jusqu'à maintenant, les raisons en étaient peu claires.
L'un des problèmes est que de nombreuses tumeurs opposent des défenses astucieuses au système immunitaire du patient, afin d'éviter ou de survivre à ces attaques. Par exemple, les mélanomes et d'autres tumeurs provoquent une lymphangiogenèse au moyen d'une protéine nommée « facteur de croissance endothélial vasculaire » (en anglais VEGF-C). La présence de VEGF-C, et la lymphangiogenèse qui s'ensuit, signalent la présence de métastases et induisent un diagnostic défavorable pour le patient. De plus, des études récentes ont aussi suggéré que VEGF-C pouvait aider les tumeurs à éviter le système immunitaire du patient.
Pour cette raison, une équipe de scientifiques conduits par le laboratoire de Melody Swartz à l'EPFL (maintenant à l'Université de Chicago), avec comme coauteurs principaux Manuel Fankhauser et Maria Broggi, a émis l'hypothèse que la lymphangiogenèse et l'immunosuppression pouvaient entraver l'efficacité de l'immunothérapie.
De manière surprenante, les scientifiques ont découvert que VEGF-C et la lymphangiogenèse pouvaient au contraire accroître fortement les effets de l'immunothérapie sur les mélanomes. La découverte était inattendue, alors que les scientifiques étaient en train d'essayer d'améliorer l'immunothérapie en bloquant VEGF-C chez des souris atteintes de mélanome. Au lieu de cela, ils ont observé l’inverse: l’effet de l'immunothérapie chez les souris porteuses de mélanomes s'est avéré moins bon lorsque la lymphangiogenèse était bloquée.
En menant des études supplémentaires, les chercheurs ont trouvé une explication à leurs observations: les nouveaux vaisseaux lymphatiques créés par la tumeur de mélanome sécrètent la chémokine CCL21, qui attire activement les lymphocytes T naïfs (indifférenciés) dans le micro-environnement immunosupprimé de la tumeur. Une fois dans la tumeur, ces lymphocytes T sont activés localement à la suite de la mort des cellules cancéreuses provoquée par l'immunothérapie, ce qui déclenche une boucle de rétroaction d'immunité anti-tumorale de longue durée.
L'équipe a testé son hypothèse sur différents modèles de souris atteintes de mélanomes en utilisant des approches multiples d'immunothérapie, y compris la vaccination et le transfert adoptif de lymphocytes T. Toutes ces approches ont éradiqué ou ralenti la croissance des tumeurs de mélanomes, et dans certaines configurations elles ont même conféré à la souris une protection de longue durée contre les métastases.
Au-delà des modèles pré-cliniques, les scientifiques ont testé leur hypothèse sur des patients humains atteints de mélanomes. «La différence a vraiment été frappante», dit Melody Swartz. «Quasi tous les patients présentant des niveaux de VEGF-C plus élevés que la moyenne dans le sang ont réagi à l'immunothérapie. Cela s'est traduit non seulement par l'éradication des tumeurs primaires, mais par une stimulation de l'infiltration de lymphocytes T dans les tumeurs métastatiques, et une protection à long terme». Dès lors, les chercheurs suggèrent que VEGF-C peut être un biomarqueur permettant de dire dans quelle mesure un patient peut répondre à l'immunothérapie.
«Nous mesurons maintenant les nombreux mécanismes d'immunosuppression qu'une tumeur enflammée par des lymphocytes T développe pour survivre, y compris la lymphangiogenèse», écrivent les auteurs. «Mais quand la balance penche du côté des facteurs d'activation plutôt que de ceux de suppression, comme c'est le cas dans l'immunothérapie, ces lymphocytes T deviennent des acteurs puissants de l'immunité anti-tumorale».
Ces découvertes révèlent un rôle sous-estimé de la lymphangiogenèse associée à une tumeur dans la formation du micro-environnement immunitaire de la tumeur, et ouvre la voie à des stratégies thérapeutiques pour l'exploiter. L'étude revêt une importance particulière pour l'immunothérapie anti-cancéreuse, qui est en train de devenir une arme extraordinaire contre les tumeurs de différents types. Par exemple, la FDA a récemment approuvé la thérapie CAR-T pour la leucémie, et plusieurs inhibiteurs de points de contrôle ont déjà été approuvés pour le traitement de tumeurs solides telles que les mélanomes. Ce sont là des traitements révolutionnaires qui désormais guérissent des patients qui, jusqu'ici, n'avaient que de faibles chances de survie.
Institutions ayant contribué
- Institute for Molecular Engineering and The Ben May Institute for Cancer Research, University of Chicago
- Département d'oncologie et Ludwig Cancer Research, Université de Lausanne
- Oregon Health and Science University
- Bioinformatics and Biostatistics Core Facility, EPFL
- Institut suisse de recherches expérimentales sur le cancer (ISREC), EPFL
Financement
- Fonds National Suisse
- Swiss TransMed
- Conseil de la recherche européen (ERC)
- Fonds Pierre-François Vittone
Référence
Manuel Fankhauser, Maria A.S. Broggi, Lambert Potin, Natacha Bordry, Laura Jeanbart, Amanda W. Lund, Elodie Da Costa, Sylvie Hauert, Marcela Rincon-Restrepo, Christopher Tremblay, Elena Cabello, Krisztian Homicsko, Olivier Michielin, Douglas Hanahan, Daniel E. Speiser, Melody A. Swartz. Tumor lymphangiogenesis promotes T cell infiltration and potentiates immunotherapy in melanoma. Science Translational Medicine 13 September 2017. DOI: 10.1126/scitranslmed.aal4712