CRISPR révèle la vie secrète des peptides antimicrobiens
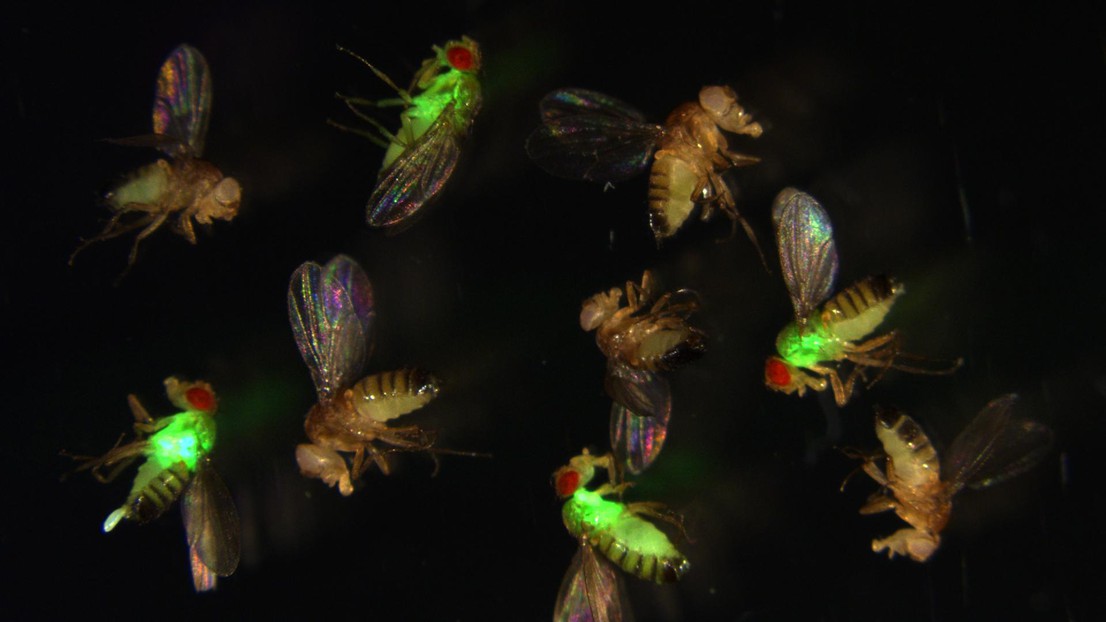
Les drosophiles avec des PAM mutés (rouge) laissent proliférer les bactéries (vertes) de façon incontrôlable, tandis que les mouches sauvages suppriment l’infection. Crédit: Mark Austin Hanson, EPFL
À l’aide de la technique CRISPR, des scientifiques de l’EPFL ont mené des travaux importants sur une arme encore méconnue mais efficace du système immunitaire inné: les peptides antimicrobiens.
Lorsqu’on parle du système immunitaire, on pense habituellement aux lymphocytes de type B et T ou aux macrophages sans cesse en mission de recherche et de destruction des agents pathogènes envahisseurs comme les bactéries ou les virus. Or notre système immunitaire inclut une première ligne de défense moins connue et moins étudiée appelée «immunité innée».
L’une des principales armes de l’immunité innée est constituée par une famille de peptides de petite taille nommés «peptides antimicrobiens» ou PAM. Ces derniers sont fabriqués par les cellules de l’hôte (p. ex. de l’humain) et combattent les microorganismes envahisseurs en altérant leur membrane cellulaire ou en perturbant leurs fonctions.
Malgré leur importance, nos connaissances sur les PAM sont minimes. Des études in vitro ont montré qu’ils pouvaient tuer les bactéries et les champignons, mais les scientifiques rencontraient beaucoup de difficultés à les étudier dans les organismes vivants. L’une des raisons découle du nombre simplement trop élevé de facteurs impliqués dans l’immunité innée. Isoler l’effet des PAM dans un organisme vivant est dès lors une opération très complexe.
Mais nous disposons aujourd'hui de l’outil nécessaire: les scientifiques du laboratoire de Bruno Lemaitre à l’Institut d’Infectiologie et de Santé globale de l’EPFL ont utilisé la technique de génie génétique CRISPR pour détruire pas moins de quatorze PAM de la mouche drosophile. En supprimant des gènes PAM uniques, diverses combinaisons de gènes ou même la totalité des quatorze gènes, les scientifiques sont parvenus à éliminer leurs PAM correspondants et à observer comment leur absence influence la résistance de la mouche aux différents agents pathogènes bactériens et fongiques.
Les résultats ont montré que les PAM agissent essentiellement contre les bactéries à Gram négatif (p. ex. E. coli, espèces d’entérobactéries) et certains champignons, du moins pour la drosophile. Les PAM travaillent soit ensemble soit en unissant leurs effets individuels. Non sans surprise, les chercheurs ont découvert que certains PAM sont capables d’une défense extrêmement spécifique contre quelques infections (p. ex. PAM diptéricine contre l’agent pathogène P. rettgeri). Ce résultat inattendu souligne la spécificité de la réponse immunitaire innée à un degré insoupçonné jusque-là.
«Ce qui est vraiment passionnant, c’est que ces résultats nous aideront à comprendre comment nos propres PAM peuvent contribuer à lutter contre les infections, explique Mark Austin Hanson, le principal auteur de l’étude. Certaines personnes pourraient posséder une copie défectueuse d’un PAM spécifique nécessaire à la prévention d’une infection courante, telle que les E. coli uropathogènes, et ainsi être exposées à des risques plus élevés. Il est certes utile de combattre les infections, mais l’idéal de la médecine consiste en premier lieu à apprendre à les prévenir. C’est précisément le rôle des PAM: ils empêchent l’infection de s’établir.»
Mark Austin Hanson ajoute que l’étude des PAM compte encore d’autres applications: «L’examen du fonctionnement des PAM de la mouche nous aidera à nous consacrer à des opérations impliquant des insectes importants sur le plan économique, notamment protéger les abeilles ou empêcher les moustiques de répandre des maladies.»
Autres contributeurs
- Université de Paris-Saclay
- National Institute of Genetics (Japon)
Mark Austin Hanson, Anna Dostalova, Camilla Ceroni, Mickael Poidevin, Shu Kondo, Bruno Lemaitre. Synergy and remarkable specificity of antimicrobial peptides in vivo using a systematic knockout approach. eLife 26 février 2019. DOI: 10.7554/eLife.44341