Comment passe le courant: un neurorécepteur en 3 dimensions
© 2014 EPFL
Des chercheurs de l’EPFL ont mis au jour la structure tridimensionnelle d’un important neurorécepteur. Une découverte qui va permettre de mieux saisir les mécanismes relatifs à la transmission des signaux électriques entre neurones.
Les neurones sont des cellules présentes dans le cerveau, la moelle épinière et l’ensemble de notre système nerveux. Ils communiquent entre eux grâce à des signaux électriques générés par des substances chimiques. Celles-ci se lient à des structures à la surface des neurones, les neurorécepteurs, qui ont pour fonction d’ouvrir ou de fermer la voie au signal électrique. Le neurorécepteur nommé 5HT3-R est connu pour son implication dans des phénomènes comme la nausée post chimiothérapie, l’anxiété et de nombreux désordres neurologiques, tels la schizophrénie. Malgré son importance, son fonctionnement exact restait jusqu’ici méconnu et sa complexité empêchait les scientifiques de déterminer sa structure. Or, un article de Nature explique que des chercheurs de l’EPFL ont désormais levé le voile sur la structure trimdimensionnel du 5HT3-R. Cette découverte permettra de mieux comprendre don fonctionnement, mais aussi favorisera la compréhension d’autres neurorécepteurs.
Structure et fonction des neurorécepteurs
La communication entre les neurones passe par les neurorécepteurs, qui sont incorporés dans la membrane cellulaire de chaque neurone. Le phénomène commence par la libération d’une molécule appelée « neurotransmetteur », qui se lie au «neurorécepteur» d’un neurone voisin. Une fois lié, le neurotransmetteur amène le neurorécepteur à ouvrir une voie de transmission électrique, qui permet le passage d’une charge le long de la membrane neuronale. Celle-ci peut donc transporter l’électricité pendant une fraction de milliseconde, générant une impulsion électrique qui voyage à travers le neurone. Les neurorécepteurs qui fonctionnent ainsi sont très répandus dans le système nerveux et forment une famille désignée sous le nom de ligand-gated channel.
On ne comprend toutefois pas exactement comment la liaison d’un neurotransmetteur peut ouvrir un chemin capable de transporter le signal électrique. Or, la connaissance de tels fonctionnements moléculaires est primordiale pour la médecine. Les neurorécepteurs sont impliqués dans une foule de maladies neurologiques. Jusqu’ici, aucun neurorécepteur de mammifère de type ligand-gated channel n’avait été décrit structurellement, ce qui entravait la compréhension de leur fonctionnement au niveau cellulaire.
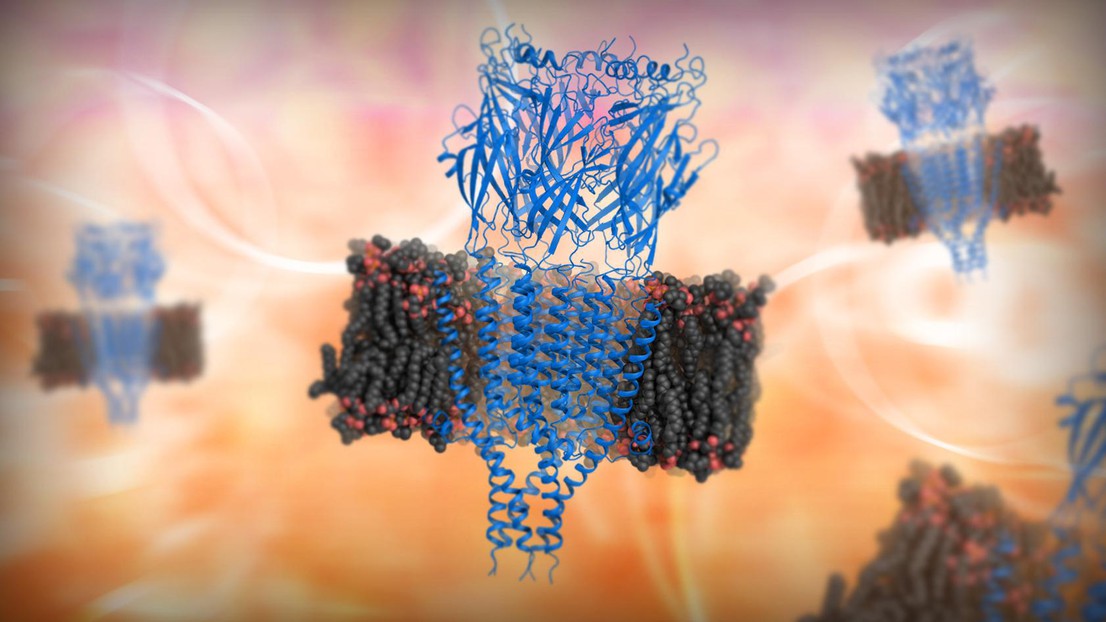
La structure du 5HT3-R dévoilée
Afin de déterminer la structure 3D du neurorécepteur 5HT3-R, l’équipe de Horst Vogel de l’EPFL a employé la cristallographie à rayons X. Celui-ci identifie le neurotransmetteur appelé «sérotonine» et ouvre un canal à travers la membrane du neurone qui permet aux signaux électriques de s’y acheminer. Le 5HT3 a été généré dans des cultures de cellules humaines, puis isolé et cristallisé.
L’équipe de l’EPFL a cependant dû relever toute une série de défis avant d’obtenir des cristaux de 5HT3-R. Du fait de sa taille relativement importante et de son incorporation dans la membrane, 5HT3-R était complexe à isoler dans des échantillons en qualité en quantité suffisante. Des années de recherche ont été nécessaire aux chercheurs pour obtenir quelques milligrammes de 5HT3-R, trop peu malheureusement pour cultiver des cristaux avec les méthodes conventionnelles.
La qualité du cristal obtenu était par ailleurs insuffisante. L’équipe a eu recours à de petits anticorps, appelés «nanocorps», issus de lamas auxquels on a injecté du 5HT3-R purifié. De tous les nanocorps isolés, l’un d’eux était capable de former un complexe stable avec le 5HT3-R, et permettait de produire des cristaux de haute qualité.
La suite de la procédure s’est révélée plus simple: les cristaux dédiés à la cristallographie à rayons X ont été étudiés au département synchrotron de l’Institut Paul Scherrer à Villigen ainsi qu’à l’ESFR de Grenoble. Grâce à une technique bien établie, ces cristaux ont diffracté les rayons X selon un modèle caractéristique susceptible de reconstruire la structure 3D.
Ces expériences de diffraction par rayons X ont permis de visualiser la structure 3D du 5HT3-R à une résolution inédite de 3.5 Ångstroms (3.5 x 10-10 mètres). L’image obtenue montre un récepteur 5HT3 de la forme d’une balle, entouré de cinq structures disposées symétriquement autour d’un canal central, lequel traverse la membrane cellulaire du neurone. Ce canal peut avoir deux états: fermé ou ouvert. Il est ainsi capable de transporter l’électricité après s’être lié à un neurotransmetteur, libérant un flux de charges électriques à l’intérieur et à l’extérieur du neurone.
«Nous avons désormais l’anatomie moléculaire d’un récepteur qui joue un rôle central dans la transmission neuronale, explique Horst Vogel. « C’est la première structure 3D de ce type, et elle pourra servir de référence à d’autres récepteurs de la même famille. Nous devons désormais améliorer sa résolution afin d’obtenir des informations importantes, par exemple pour la création de nouveaux traitements influençant la fonction de ce neurorécepteur.»
---
Cette étude a été réalisé par le Laboratoire de Chimie Physique et Membranes de l’EPFL, en collaboration avec le Center for Cellular Imaging and NanoAnalytics de l’Université de Bâle, le Swiss Light Source et Laboratoire de Recherche Biomoléculaire de l’Institut Paul Scherrer, le Laboratoire Architecture et Fonction des Macromolécules Biologiques du Centre National de la Recherche Scientifique, l’Université Grenoble Alpes et l’Unité de Dynamique Structurale des Macromolécules de l’Institut Pasteur.
Source
Hassaine G, Deluz C, Grasso L, Wyss R, Tol MB, Hovius R, Graff A, Stahlberg H, Tomizaki T, Desmyter A, Moreau C, Li X-D, Poitevin F, Vogel H, Nury H. X-ray structure of the mouse serotonin 5-HT3 receptor. Nature DOI: 10.1038/nature13552.