Le squelette de nos cellules en très haute résolution
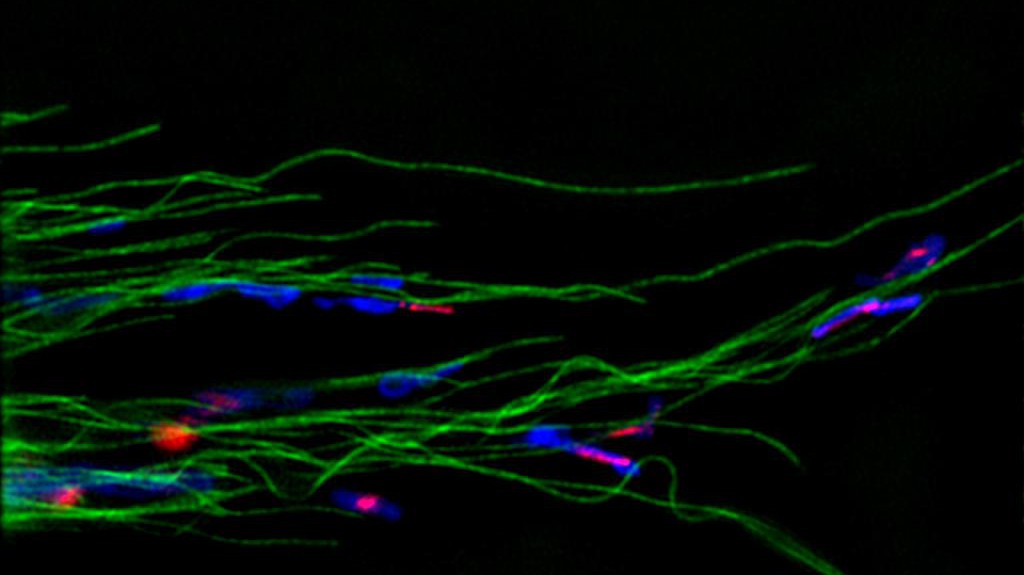
SiR-tubulin colorée en vert © Kai Johnsson/EPFL
Les cellules ont leur propre squelette, à l’origine de nombreuses fonctions. Des chercheurs de l’EPFL ont développé des sondes fluorescentes novatrices, qui facilitent et améliorent substantiellement l’imagerie cellulaire de ces minuscules structures.
Le cytosquelette est une large structure à l’intérieur des cellules. Il leur offre un soutien mécanique, maintient leur forme tridimensionnelle et leur organisation interne, et leur permet de se mouvoir et de se diviser. Il est fait de trois principales sous-structures, constituées de longues protéines filamenteuses appelées tubuline et actine.
Les techniques actuelles d’observation du cytosquelette peuvent poser problème lorsqu’il s’agit de le visualiser à l’intérieur de cellules vivantes. Elles impliquent souvent des substances toxiques, et sont limitées en termes de résolution et de durée d’action. On utilise souvent la microscopie à fluorescence, dans laquelle les molécules fluorescentes (« sondes ») sont attachées aux structures cellulaires puis « éclairées » sur un fond sombre.
L’équipe de Kai Johnsson de l’EPFL a créé des sondes moléculaires fluorescentes capables d’entrer facilement dans les cellules vivantes. Non toxiques, elle restent actives durablement, et, plus important encore, permettent une résolution d’image sans précédent. En 2013, les chercheurs avaient déjà développé une molécule fluorescente, la silicon-rhodamine (SiR), qui «s’allume» en émettant des infrarouges, mais seulement quand elle s’attache à la surface chargée d’une protéine comme celles trouvées sur le cytosquelette.
Le défi était de faire en sorte que le SiR se lie spécifiquement aux protéines du cytosquelette, l’actine et la tubuline. Les scientifiques ont fusionnéla silicon-rhodamine et des composants qui s’attachent à la tubuline ou à l’actine. Il en résulte des molécules hybrides, formées d’une molécule de SiR, qui fournit le signal fluorescent, et d’un composé naturel qui se lie à la protéine cible, par exemple le docétaxel, un médicament anticancéreux qui s’attache à la tubuline, ou la jasplakinolide, qui se lie avec l’actine du cytosquelette. Ces deux composants, employés à des concentrations très basses et non toxiques, passent facilement à travers la membrane cellulaire puis dans la cellule elle-même.
Les sondes moléculaires (SiR-tubulin et SiR-actin) ont été utilisées pour visualiser la dynamique du cytosquelette dans des cellules de peau humaine. Comme leur signal lumineux est de type infrarouge lointain, il est facile à isoler du bruit de fond. Résultat: des images d’une précision sans précédent en microscopie haute-résolution.
Ces sondes moléculaires ont également des atouts pratiques. « Vous les ajoutez directement à la culture cellulaire, et elles diffusent dans les cellules », déclare Kai Johnsson. Elle ne requièrent ni lavement ni préparation des cellules avant administration, ce qui aide à maintenir leur stabilité environnementale et leurs fonctions biologiques naturelles.
Les scientifiques pensent qu’ils peuvent étendre leur travail à d’autres types de protéines et de tissus. «Les biologistes ont constamment recours à l’imagerie des structures du cytosquelette, explique Kai Johnsson. Jusqu’ici, aucune sonde disponible ne permettait d’obtenir des images de haute qualité des microtubules et des microfilaments à l’intérieur des cellules vivantes sans modification génétique. Avec notre travail, nous fournissons à la communauté scientifique deux outils ultraperformants, à contraste élevé, qui émettent dans la zone non phototoxique du spectre lumineux, et qui peuvent même être utilisées dans les tissus comme des échantillons de sang complet. »
---
Cette étude a été réalisée par l’Institut des sciences et d’ingénierie chimique de l’EPFL (ISIC), en collaboration avec l’Institut de bio-ingénierie (IBI), la Plateforme de bio-ingénierie et d’optique (BIOP), le Pôle de recherche national (NCCR) en biologie chimique; les Instituts Max-Planck de chimie biophysique (Göttingen) et de physiologie moléculaire (Dortmund); l’Institut de chimie organique de l’Université Friedrich-Schiller (Iéna); ainsi que l’Institut de biotechnologie moléculaire de l’Académie autrichienne des sciences (IMBA) (Vienne).
Source
Lukinavičius G, Reymond L, D’Este E, Masharina A, Göttfert F, Ta H, Güther A, Fournier M, Rizzo S, Waldmann H, Blaukopf C, Sommer C, Gerlich DW, Arndt HD, Hell SW, Johnsson K. Fluorogenic probes for live-cell imaging of the cytoskeleton. Nature Methods 25 May 2014. DOI: 10.1038/nmeth.2972