Fonctionnement d'une enzyme critique dans une cellule
iStock photos
En combinant la biologie structurelle, les simulations moléculaires, la mutagenèse et des essais in vivo, des scientifiques de l’EPFL ont mené la première étude approfondie sur le mode d’action de l’enzyme acyl thioestérase, qui régule la désacylation, l’une des fonctions les plus essentielles d’une cellule.
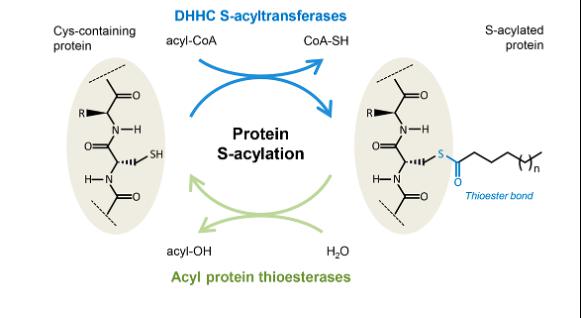
La S-acylation est le processus de liaison chimique d’un lipide à une protéine via une liaison thioester. Il s’agit d’un processus cellulaire important qui régule la localisation et le fonctionnement de nombreuses protéines. Il favorise l’association membranaire lipidique de la protéine, par exemple à la membrane plasmique, à l’appareil de Golgi ou à une membrane nucléaire interne.
À l’instar de la plupart des processus biochimiques cellulaires, la S-acylation des protéines est réversible pour réguler les fonctions des protéines acylées. La S-acylation est inversée par les enzymes acyl-protéines thioestérases (APT).
Pour remplir leur fonction, les APT doivent interagir avec les membranes lipidiques auxquelles sont liées leurs protéines cibles. Toutefois, même si les APT sont au cœur de ce processus essentiel d’acylation et de désacylation, on sait peu de choses sur leur fonctionnement.
Aujourd’hui, des scientifiques sous la houlette de Gisou van der Goot et de Matteo Dal Peraro à la Faculté des sciences de la vie de l’EPFL ont fait d’importantes découvertes qui permettent de mieux comprendre le fonctionnement de l’APT2, une acyl thioestérase essentielle dans une cellule. Leurs travaux sont publiés dans Nature Chemical Biology.
Tout d’abord, les chercheurs ont montré que les APT présentent une capacité de liaison membranaire intrinsèque. En combinant la cristallographie aux rayons X et les simulations de dynamique moléculaire, ils ont démontré que les APT renferment dans leur structure des patchs positivement chargés qui leur permettent d’attirer électrostatiquement la bicouche lipidique d’une membrane.
L’équipe a également découvert une boucle modérément hydrophobe à la surface des APT qu’elle a appelée «ruban β», ce qui permet à l’enzyme d’avoir des interactions hydrophobes avec la membrane.Les chercheurs ont synthétisé des mutants APT2 avec des rubans β déficients et ont découvert qu’ils étaient devenus incapables de se lier aux membranes. Ils ont donc conclu que la capacité des APT2 (et autres thioestérases par extension) à se lier aux membranes est arbitrée par la séquence de rubans ß.
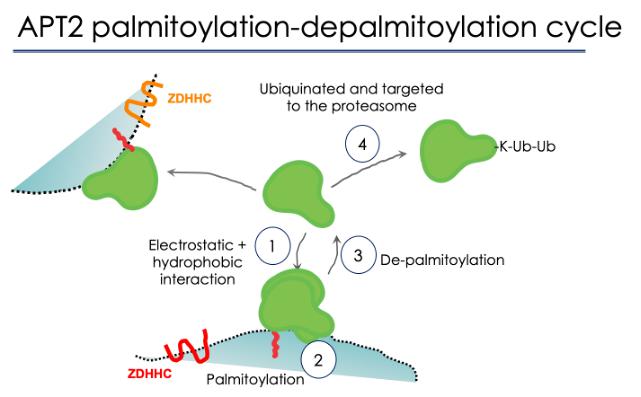
En analysant la structure des APT2, les chercheurs ont également identifié un site qui peut conduire à sa dégradation. Ce site permet à l’enzyme d’être liée par l’ubiquitine, une protéine que les cellules utilisent pour marquer les molécules en vue de leur dégradation. Essentiellement, l’APT2 comporte un mécanisme de contrôle intégré pour sa propre dégradation – mais cela peut se produire uniquement après la désacylation de sa cible et sa libération. Par ailleurs, une fois qu’une tâche est terminée, l’APT2 peut se déplacer vers une autre membrane, se lier à elle et désacyler une autre protéine.
Les chercheurs se sont alors penchés sur la S-acylation de l’APT2. De précédentes études ont révélé que l’enzyme s’est beaucoup accumulée dans l’appareil de Golgi des cellules, l’organelle qui enveloppe la nouvelle protéine dans des vésicules avant de les faire sortir de la membrane cellulaire.
À l’aide d’un autre mutant APT2, les chercheurs ont pu déterminer que cette accumulation dépend de la S-acylation de l’APT2 – sur un acide aminé cystéine le long de sa séquence (Cys2). En bref, la S-acylation sur Cys-2 est indispensable pour que l’APT2 puisse se lier aux membranes lipidiques de manière stable et désacyler ses cibles dans les cellules.
L’équipe a ensuite recherché les éventuelles enzymes candidates qui peuvent acyler l’APT2. Pour ce faire, elle a passé en revue toutes les enzymes palmitoyltransférases. Les résultats ont montré que l’APT2 peut être S-acylée par l’une des deux palmitoyltransférases, ZDHHC3 ou ZDHHC7.
Enfin, les scientifiques ont rassemblé leurs données pour comprendre comment l’APT2 se lie réellement aux membranes lipidiques, ce qui est indispensable à sa capacité d’assurer ses fonctions dans les cellules.
Ils ont découvert que l’APT2 se lie aux membranes selon un processus en trois étapes. D’abord, des interactions électrostatiques de longue portée attirent l’enzyme, via ses patchs positifs, jusqu’à la membrane lipidique. Là, le ruban β «s’enfonce» dans la membrane et maintient l’APT2 temporairement en place, ce qui est nécessaire à sa «rencontre» avec les enzymes qui l’acyleront. L’APT2 est alors liée de manière stable à la membrane et prête à réaliser ses fonctions de désacétylation.
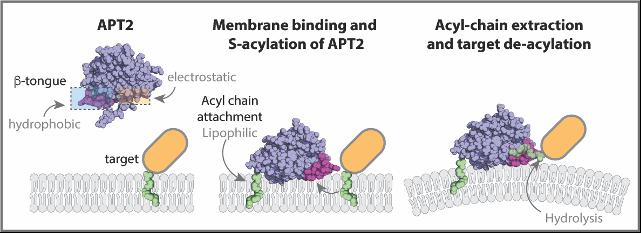
«Cette étude montre que l’APT2 est en réalité un hybride entre une protéine porteuse lipidique, qui peut extraire le lipide des membranes, et une hydrolase, qui peut couper le lipide d’une protéine», déclare Gisou van der Goot.
Autres contributeurs
- Plateforme technologique de la production et structure des protéines de l’EPFL
- Institut suisse de bioinformatique (Swiss Institute of Bioinformatics)
Fonds national suisse de la recherche scientifique (NCCR Chemical Biology)
Conseil européen de la recherche (septième programme cadre de l’Union Européenne)
Laurence Abrami, Martina Audagnotto, Sylvia Ho, Maria Jose Marcaida, Francisco S. Mesquita, Muhammad U. Anwar, Patrick A. Sandoz, Giulia Fonti, Florence Pojer, Matteo Dal Peraro, F. Gisou van der Goot. Molecular mode of action of an Acyl Protein thioesterase. Nature Chemical Biology 11 March 2021. DOI: 10.1038/s41589-021-00753-2