Des organes miniaturisés pour faire avancer la recherche
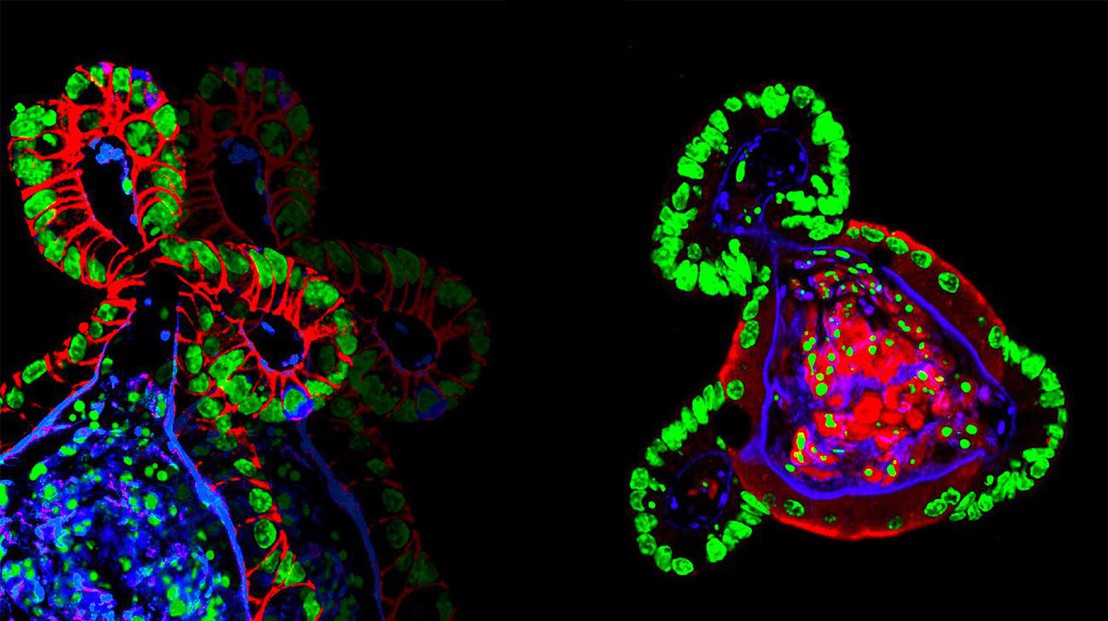
Organoïdes intestinaux cultivés dans des hydrogels synthétiques © N. Gjorevski / EPFL
Des scientifiques de l'EPFL ont développé un gel pour faire croître des organes miniaturisés pouvant être utilisés dans les diagnostics cliniques et le développement de médicaments.
Les organoïdes sont de minuscules organes qui peuvent être cultivés en laboratoire à partir des cellules-souches d'un individu. Ils peuvent aussi être utilisés pour modéliser des maladies, et pourront l'être à l'avenir pour tester des médicaments, ou même remplacer des tissus endommagés chez un patient. A l'heure actuelle pourtant, il est très difficile de cultiver des organoïdes d'une manière standardisée et contrôlée, ce qui pourtant est essentiel pour les concevoir et les utiliser. Des scientifiques de l'EPFL viennent de résoudre le problème en développant un «hydrogel», en instance de brevet, qui permet de cultiver des organoïdes de manière contrôlable et modulable. La découverte est publiée dans Nature.
Les organoïdes ont besoin d'un squelette 3D
La culture des organoïdes commence avec des cellules-souches – des cellules immatures qui peuvent se développer en n'importe quel type de cellule du corps humain, et qui jouent un rôle primordial dans le fonctionnement et la régénération des tissus. Pour former un organoïde, les cellules-souches sont cultivées à l'intérieur de gels à trois dimensions contenant un mélange de biomolécules qui favorisent le renouvellement et la différentiation des cellules-souches.
Le rôle de ces gels est de reproduire l'environnement naturel des cellules-souches, lequel leur fournit un squelette riche en protéines et en sucres nommé «matrice extra-cellulaire», sur lequel les cellules-souches construisent des tissus corporels spécifiques. Les cellules-souches se collent au gel de la matrice extra-cellulaire, puis s'«auto-organisent» en de minuscules organes tels que des rétines, des reins, ou de l'intestin. Ces petits organes conservent les aspects-clé de leur biologie dans la vraie vie, et peuvent être utilisés pour étudier des maladies ou tester des médicaments avant de les soumettre à des essais humains.
Une solution par l'hydrogel
Le laboratoire de Matthias Lütolf à l' Institut interfacultaire de Bioingénierie de l'EPFL a développé un «hydrogel» synthétique qui évite les inconvénients des gels d'origine naturelle conventionnels. Le gel en instance de brevet est constitué d'eau et de polyéthylène glycol, une substance largement utilisée aujourd'hui sous différentes formes, des crèmes pour la peau et des dentifrices aux applications industrielles et, dans le cas présent, à la bio-ingénierie.
Nikolce Gjorevski, auteur principal de l'étude, et ses collègues se sont servis de l'hydrogel pour développer des cellules-souches de l'intestin en un intestin miniature. L'hydrogel fonctionnel était non seulement un but en soi et pour soi, mais aussi le moyen d'identifier les facteurs qui influencent la capacité des cellules-souches à croître et à former des organoïdes. En ajustant soigneusement les propriétés de l'hydrogel, ils ont découvert que les étapes distinctes du processus de formation des organoïdes exigent des environnements mécaniques et des composants biologiques différents.
L'un de ces facteurs est une protéine appelée fibronectine, qui aide les cellules-souches à s'attacher à l'hydrogel. Le laboratoire de Lütolf a trouvé que cette liaison elle-même est extrêmement importante pour cultiver des organoïdes, dans la mesure où elle déclenche une multitude de signaux à l'intention de la cellule-souche pour lui dire de croître et de construire une structure de type intestinal. Les chercheurs ont aussi découvert le rôle essentiel des propriétés mécaniques, soit la rigidité physique du gel, pour réguler le comportement de la cellule-souche intestinale. Cela éclaire la manière dont les cellules sont capables de sentir, traiter et réagir à des stimuli physiques. Cet éclairage est particulièrement précieux: alors que l'influence de signaux biochimiques sur les cellule-souches est bien compris, l'effet de facteurs physiques demeurait plus mystérieux.
Dans la mesure où l'hydrogel est de fabrication humaine, il est facile de contrôler sa composition chimique et ses propriétés principales, et d'assurer une constance entre les lots. Et parce qu'il est artificiel, il ne comporte aucun risque d'infection, ni ne peut déclencher des réponses immunitaires. Comme tel, il offre un moyen de faire évoluer les organoïdes de la recherche fondamentale à des applications pharmaceutiques et cliniques réelles dans le futur.
Le laboratoire de Lütolf recherche maintenant d'autres types de cellule-souches, de manière à étendre les capacités de son hydrogel à d'autres tissus.
Ce travail résulte d'une collaboration entre l'Institut interfacultaire de Bioingénierie (IBI) de l'EPFL, l'Institut suisse de recherche expérimentale sur le cancer (ISREC), et de l'Institut des sciences et ingénierie chimiques (ISIC), avec le Hubrecht Institute et le University Medical Center Utrecht (Netherlands). Il a été financé par une bourse de la European Molecular Biology Organization (EMBO) et le soutien de l'EPFL.
Référence
Nikolce Gjorevski, Norman Sachs, Andrea Manfrin, Sonja Giger, Maiia E. Bragina, Paloma Ordóñez-Morán, Hans Clevers, Matthias P. Lutolf. Designer matrices for epithelial stem cell and organoid culture. Nature 16 November 2016. DOI: 10.1038/nature20168