Des lasers pour sculpter et faire croître des tissus vivants

Fabrication de réseaux microfluidiques dans des gels biocompatibles utilisant des lasers pulsés © M. Lütolf/EPFL
Faire croître de véritables organes à partir de cellules de culture? L'ingénierie tissulaire fait un pas de plus dans cette direction grâce à la technique développée à l'EPFL, qui combine microfluidique et lasers.
La médecine cherche à intégrer des technologies d’ingénierie tissulaire, telles que des organes sur puces et des organoïdes – de minuscules organes conçus à partir de cellules-souches. Mais ces développements reposent sur une tâche à la fois simple et complexe: contrôler le comportement cellulaire en trois dimensions. Jusqu’ici, la plupart des approches en matière de cultures cellulaires se sont limitées à des environnements à deux dimensions (par exemple la boîte de Petri). Mais ces méthodes ne reproduisent pas les conditions réelles. Il est dès lors impossible de constituer des tissus complexes et des organes. Deux scientifiques de l’EPFL viennent de développer une nouvelle méthode qui utilise des lasers pour creuser des passages dans des gels biocompatibles afin d’influencer localement la fonction cellulaire et de promouvoir la formation de tissu. Le travail est publié dans Advanced Materials.
Dans l’organisme, les cellules croissent dans de micro-espaces à trois dimensions qui sont spécifiques à chaque type de tissu – foie, rein, cœur, cerveau, etc. Ces microenvironnements sont important parce qu’ils contrôlent le comportement des cellules: par exemple la manière dont elles interagissent avec d’autres parties du tissu pour l’aider à se développer, fonctionner et se réparer. De plus, les microenvironnements eux-mêmes sont très dynamiques et adaptables, envoyant aux cellules divers signaux biochimiques pour qu’elles adaptent leur comportement aux changements physiologiques.
Cela signifie que pour constituer des organes fonctionnels à partir de cellules de culture, il faut d’abord être capable de faire croître des cellules dans des espaces trimdimensionnels. Matthias Lütolf et sa doctorante Nathalie Brandenberg, qui travaillent à l’Institut de Bioingénierie de l’EPFL, ont développé une méthode qui utilise un laser pour tailler des passages en trois dimensions à l’intérieur d’une structure d’hydrogel comparable à l'environnement naturel des cellules.
La méthode combine lasers et microfluidique – la science par laquelle on peut contrôler les fluides dans des espaces d’une taille micrométrique. Les scientifiques ont eu recours à des lasers focalisés à impulsions brèves, qui peuvent générer assez de puissance pour créer de minuscules tunnels dans différents gels déjà utilisés en biologie cellulaire et en ingénierie tissulaire. Le laser peut être appliqué avant ou même pendant la culture cellulaire 3D, ce qui signifie que les cellules peuvent être contrôlées en temps réel pour correspondre à leur croissance naturelle.
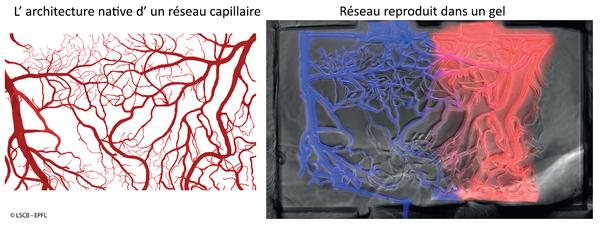
À gauche, un image représentant d'un réseau capillaire du cerveau. À droit, le réseau est reproduit dans un gel biocompatible utilisant du laser.
Dans le même temps, la microfluidique est devenue un élément essentiel de l’ingénierie tissulaire. La technologie permet de contrôler le microenvironnement des cellules. Elle peut émuler l’adaptabilité complexe des microenvironnements biologiques, par exemple en délivrant des médicament et autres molécules à même d'ajuster le comportement des cellules.
La microfluidique est largement utilisée pour construire des systèmes de culture cellulaire. Toutefois, elle reste largement limitée à des applications de culture à deux dimensions. Les efforts visant à utiliser la microfluidique dans des cultures 3D ont été couronnés de succès, mais ils impliquent de multiples étapes qui les rendent peu adaptées à des applications standardisées. En combinant la microfluidique avec la flexibilité de la découpe au laser (ou «photoablation»), Nathalie Brandenberg et Matthias Lütolf rendent cette approche plus accessible, fiable et polyvalente.
«Notre méthode s’attaque aux limitations des approches précédentes, explique Matthias Lütolf. Elle est entièrement compatible avec des cultures cellulaires 3D, et peut être appliquée à un large éventail de matériaux, différentes géométries. Nous pouvons modifier des réseaux microfluidiques existants pendant le cours de l'expérience, ce qui permet un contrôle inédit du comprtement des cellules.»
Ce travail a été financé par le programme de recherche EU framework 7 HEALTH PluriMes et une bourse CER.
Référence
Brandenberg N, Lutolf MP. In situ patterning of microfluidic networks in 3D cell-laden hydrogels. Advanced Materials 23 June 2016. DOI: 10.1002/adma.201601099